機能性表示食品について
機能性表示食品制度は、「特定保健用食品」と「栄養機能食品」のような許認可制とは異なり、事業者が制度のルール(ガイドライン)に基づき、食品の安全性と機能性に関する科学的根拠等の情報を消費者庁に届出すれば、機能性を表示することができます。
2015年4月にスタートした制度です。
| 区分 | 特定保健用食品 | 栄養機能食品 | 機能性表示食品 | その他の食品 |
|---|---|---|---|---|
| 機能性の表示 | 可 | 可 | 可 | 否 |
| 制度 | 許認可制 | 許認可制 | 届出制 | - |
機能性表示食品の特徴
-
科学的根拠(1. または2. )があれば、事業者の責任において機能性の表示が可能。
- 1. 最終製品を用いた臨床試験結果
- 2. 機能性関与成分に関する研究レビュー
【ほぼ全ての食品が対象】
機能性表示食品は、生鮮食品を含めて、一部を除いたほぼ全ての食品が対象となります。
【科学的根拠】
ヒト臨床試験または研究レビュー、関与成分の定性・定量、および作用機序の考察などの科学的根拠が必要となります。
【様々なヘルスクレームが可能】
特定保健用食品では認められていない「体の特定の部位」に関する表現も健康の維持・増進の範囲内であれば機能性表示食品では可能になり、特定保健用食品と比べて表示可能なヘルスクレームの範囲が広がります。
-
トクホ制度のような許認可制(個別審査)ではなく、消費者庁への届出により機能性の表示が可能。
【届出制による自己責任】
国が安全性・有効性を審査し許可する制度ではなく、事業者の届出による自己責任制度ですので、特定保健用食品制度と比べて、必要となる科学的根拠の量も少なく、届出から受理までの期間も短くなることが 多いです。
【求められる自己責任】
届出後に有識者や消費者、他省庁からの指摘により、より詳細な科学的根拠の開示を求められるケースもあり、届出者の自己責任が強く求められます。
【注意点】
ヒト臨床試験における注意点としては、新たな検査方法を採用した場合の科学的裏付けや、症例検討の過程について、開示可能なデータや議事録として保存することが必要と考えられます。
-
トクホ申請より、低コスト、短期間で届出が可能。
ヒト臨床試験を実施した場合にかかる、<試験~届出~受理>までの期間とコストについては、内容によって幅がございますが、特定保健用食品と比べると、期間も短くコストも圧縮されます。研究レビューを 用いた場合は、更に期間とコストが圧縮されます。
【特定保健用食品】
トータル期間:1年半~3年程度 (試験~論文投稿~申請)
有効性ヒト臨床試験費用:1,000万円~7,000万円程度
安全性ヒト臨床試験費用:400万円~700万円程度【機能性表示食品】
トータル期間:半年~1年半程度 (試験~論文投稿~届出)
有効性ヒト臨床試験費用:500万円~3,000万円程度
安全性ヒト臨床試験費用:300万円~400万円程度
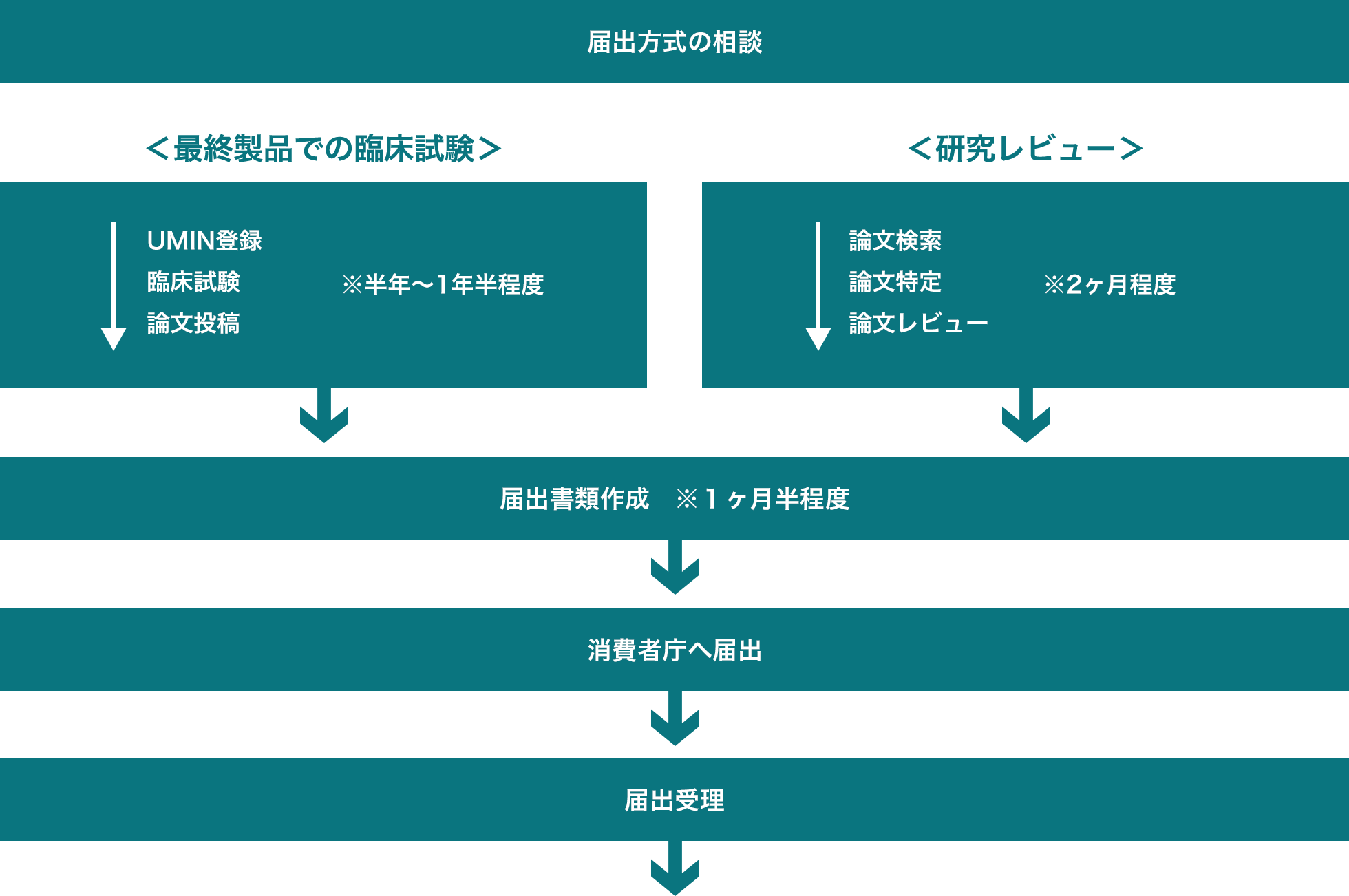
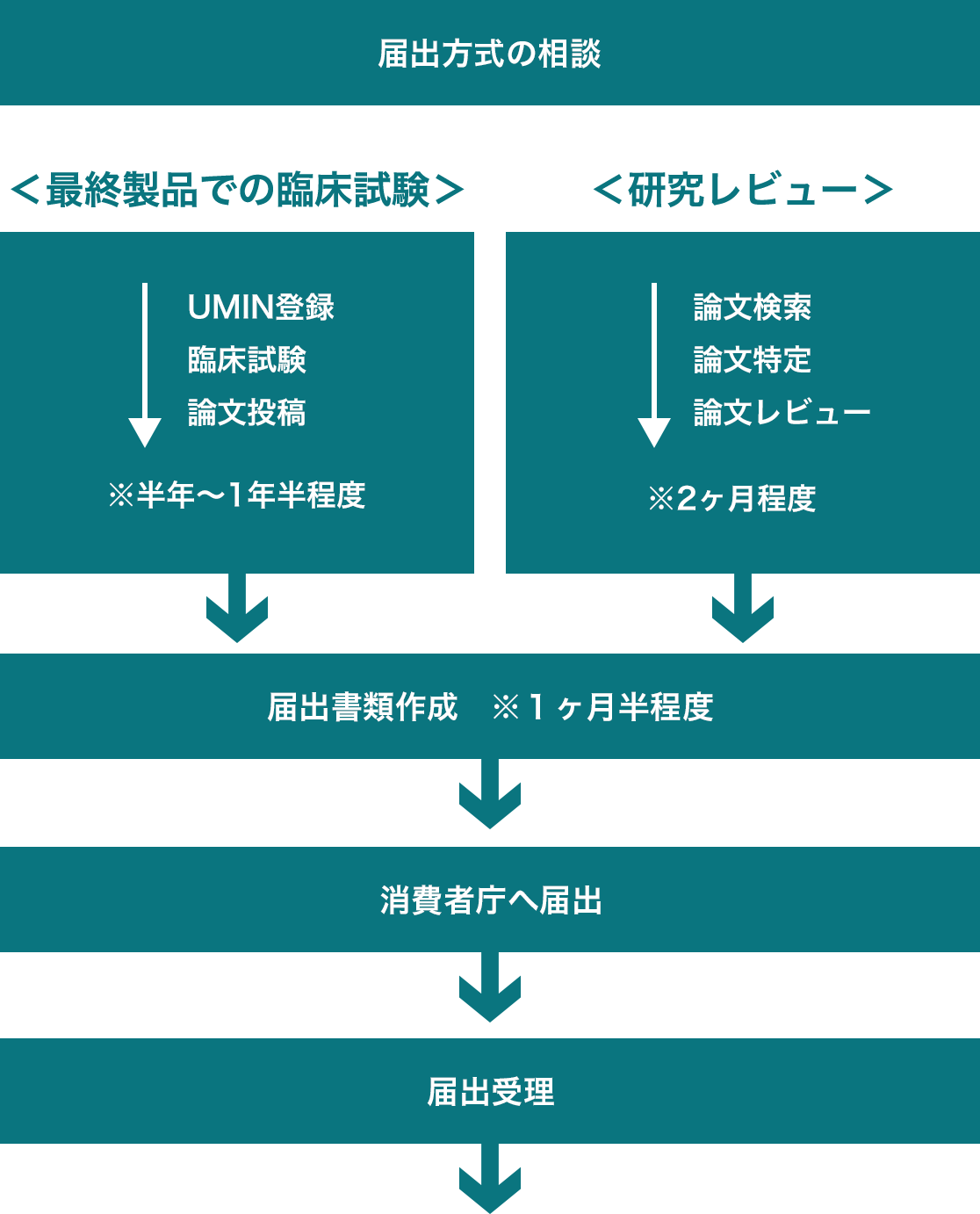
機能性表示食品の届出までの流れ
届出書類の作成や、届出から受理までの消費者庁とのやり取りも、すべてサポートします。
<研究レビュー>については、機能性表示食品の経験豊富な学術顧問のアドバイスを受けながら、
論文検索から届出書類作成までサポートします。
最終製品を用いた臨床試験を用いて届出する場合
【試験計画書の作成】
機能性表示食品のガイドラインに基づいて、有効性ヒト臨床試験及び安全性ヒト臨床試験の試験計画書を作成します。
【倫理委員会での審議】
ヒト臨床試験の計画について、被験者の権利と安全が守られていることを、有識者他で構成された倫理審査委員会(IRB)にて審議します。※「医療法人花音会みうらクリニック 倫理審査委員会」
【UMIN-CTR登録】
UMIN臨床試験登録システムにて、試験計画の事前登録を行います。知的財産の流出防止の観点から事前登録後、臨床試験の実施終了予定日より1年を超えない日を開示日とすることも可能です。
https://www.umin.ac.jp/ctr/index-j.htm
【ヒト臨床試験の実施~報告書作成~論文投稿】
- 臨床試験のデータに基づいて統計解析を実施し、試験実施報告書を作成します。
- 試験実施報告書に基づいて、論文を作成し、査読付き論文として投稿します。必要に応じて、大学研究機関等の学術専門家の共著も可能です。
最終製品または機能性関与成分に関する研究レビューを用いて届出する場合
【届出する情報】※客観性・透明性の担保、再現性が求められます。
「検索条件や採択・不採択の文献情報等」、「結果に至るプロセス」、「スポンサー及び利益相反に関する情報」、「出版バイアスの検討結果」
【研究レビュープロトコルの作成】
機能性表示食品の性状、摂取量、対象者、機能性関与成分の定量的・定性的同等性等を踏まえて、選択基準及び除外基準を設定し、プロトコルを作成します。
【研究テーマ(検索条件)の設定】
機能性表示をしようとする機能性関与成分の機能について設定をします。網羅的な検索が実施できるよう、自由語及び統制語を適切に組み合わせた検索式を設定します。成分名のみ、機能性のみの設定はできませ ん。
【研究の収集と評価】
- 検索を実施し、検索された個々の論文についてのバイアスリスクを評価します。
- エビデンス総体の評価を行うために必要十分なデータを、各論文から抽出します。
- 最終的に評価対象とした論文を、研究デザインごとに整理し、エビデンスの強さを評価します。
【機能性の関連性に関する評価】
機能性表示食品に表示しようとする機能性の科学的根拠として、研究レビュー の結果がどの程度有効かを評価します。
消費者庁への届出~受理
機能性表示食品の届出書類の作成をサポート致します。
「一般消費者向けの抄録」については、機能性の根拠に関する専門知識を有しない一般消費者に理解できるよう、なるべく専門用語を用いず平易な言葉で1,000文字以内で説明します。
記載内容は、臨床試験を実施した場合は、臨床試験の結果に関することのみ、研究レビューを実施した場合、採用文献の結果に関することのみで説明します。ただし、作用機序に関しては他の研究報告からの考察も可能です。
消費者庁へ届出後、消費者庁とのやりとりをサポートします。
機能性表示食品については、実質的な受理の基準が日々変化しており、過去に受理された試験デザインと同条件の臨床試験であっても、又は、同内容の研究レビューであっても、届出内容に対する様々な質問事項が発生します。
ワンネスサポートでは、あらゆる質問事項に対する具体的な回答方法や対応について、機能性表示食品の届出経験豊富な学術アドバイザーがサポートします。
費用の目安
最終製品での臨床試験
- 試験内容によって幅がございますが、500万円~3000万円程度となります。
- 論文作成、論文投稿もサポートします。
- 届出書類作成及び届出後の消費者庁とのやりとりもサポートします。
研究レビュー
- 届出実績のある食品かどうか等、幅がございますが290万円程度となります。
- 届出書類作成及び届出後の消費者庁とのやりとりもサポートします。
当社の食品ヒト臨床試験について
特定保健用食品、機能性表示食品のガイドラインに従い、試験デザインを提案し、機能性表示に応じて、対象被験者・評価項目・試験期間などを提案します。

- 特定保健用食品の申請、機能性表示食品の届出、各種エビデンス取得のための食品ヒト臨床試験をSOPに基づいて実施
- 被験者の選択基準、評価項目、被験食の摂取期間等について、文献や大学研究者のアドバイスに基づいて試験計画を立案
- 食事療法や健康食品・サプリメント・機能性化粧品を処方しているドクターが責任医師を担当
- 有効性試験
- 安全性試験