業界トピックス

美肌素材の商品開発活性化による機能性表示食品市場の拡大
2023.06.27
2020年は新型コロナウイルスの拡大による外出自粛やテレワークの増加により、美容サプリメントの需要が大幅に低迷していました。2021年にはマスク生活の常態化やアルコール消毒の多用のため肌トラブル対策に関する商材が求められ機能性表示食品を含めた商品開発が活発化しました。2022年に入り、徐々に外出機会が増加するのに伴い、美容市場は回復基調に向かいました。美容サプリメントの大手販売メーカーによると、「保湿サプリにおいては、コロナ渦で新規ユーザーを確保できた。商品開発の重要ポイントは、リピーターになってもらうための体感性を高めることであるということを再認識した。」「新規性・独自性の強い素材はコラーゲン・プラセンタ・セラミド・ヒアルロン酸などの大型素材との相乗効果研究を進めた一方で、画期的な機能性表示の受理を狙っている。」などの声がありました。
「肌」カテゴリーの機能性表示食品は年々受理数を伸ばしており、2023年5月30日現在、「肌」をヘルスクレームに含む機能性表示食品は704点にものぼります。セラミド、ヒアルロン酸を筆頭にN-アセチルグルコサミン、アスタキサンチン、乳酸菌、クロロゲン酸、大豆イソフラボン、コラーゲンペプチド、ローヤルゼリー、GABA、フィコシアニン、プロテオグリカン、ベータカロテン等、多岐にわたる関与成分に加えて、秋ウコンエキス、月桃葉抽出物などのエキスを関与成分とする受理品も数多くあります。表示内容における「肌の水分保持」「うるおい・保湿力サポート」「弾力維持」「紫外線対策」「肌の不快感改善」といった多様化に加えて、ダブル・トリプルヘルスクレーム商品の多さが際立っています。受理品に注目してみると、肌ケアに特化した機能性表示が半数以上であるにもかかわらず、「快眠」「ストレス」「アイケア」「整腸」「脂肪対策」と組み合わせた機能性表示の受理数も伸びています。受理企業からは、「近年の男女を問わない美容マーケットの拡大基調にあることに加え、ウィズコロナに伴うインバウンド需要の復活は機能性表示食品市場のさらなる拡大に拍車をかける」との声が上がっています。
弊社においては、多方面から「肌」ヘルスクレームにチャレンジできる臨床試験を実施することが可能です。先行で受理されている機能性表示食品の届け出データがベースとなりますが、様々な評価系があるため他社とは異なったヘルスクレームにしたいといったご要望にも対応しています。また新規ヘルスクレームにチャレンジできるような試験系も数多くありますので、ぜひお問い合わせください。
参考:健康産業新聞記事機能性表示食品の免疫表示の科学的根拠
2021.10.27
昨年夏に機能性表示食品において免疫ヘルスクレームの製品が受理されて以降、いまだに新規成分による製品が受理されていない。そうした状況で、日本抗加齢協会が今年5月から機能性表示食品の免疫機能表示のエビデンスに関する検討に着手。消費者庁をオブザーバーに迎え、免疫を専門とする学識者による検討会を行い、3回の検討を経て、(1)免疫指標について、(2)自然免疫、獲得免疫について、(3)臨床試験、(4)被験者数――に関する「考え方」をまとめた。
(1)の免疫指標について、すでに受理されている「樹状細胞の活性化」に加えて、食細胞活性、NK細胞活性ほか、有用な免疫指標を複数例示。「考え方」に記載した指標以外に、科学的根拠が説明できる指標の使用も構わないとしつつ、これらの免疫指標が「複数動いていることが望ましい」とした。
単一指標でも免疫全体を調整していることの根拠となりうるケースに言及。考え方では、「用いた指標が免疫全体を調整することを科学的に説明できることが重要」で、科学的に免疫全体を調整する作用機序を記載することが必要とした。
(2)の自然免疫・獲得免疫は、「双方を調整していることが望ましい」としたうえで、自然免疫のみでも構わないとした。ただし自然免疫のみの場合、「免疫全体を調整することが科学的に説明できないとならない」としている。
免疫指標について、既に受理されている樹状細胞の活性化に加え、食細胞活性、NK 細胞活 性、T細胞(CD4T細胞)増殖性・活性化、分泌型 IgA抗体濃度なども免疫指標として有用である。これ指標以外にも、科学的根拠が説明できる指標を使用することも構わないが、これらの免疫指標が複数動いていることが望ましい。しかし、単一の指標でも、さらに下流に応答した免疫指標に類似した指標(サイトカインなど)が動き、局所及び体全体のクリニカルアウトカムが合理的に説明できれば、免疫全体を調整していることの根拠となりうる。また、用いた指標が免疫全体を調整することを科学的に説明できることが重要であり、科学的に免疫全体を調整する作用機序を記載することが必要である。
臨床試験について、免疫指標とクリニカルアウトカムを同じ臨床試験で評価することが望ましい(サブグループにて両者を同時に評価できる場合は評価することでも十分である)。一方、両者を同時に評価していない場合は、両者を結びつける合理的な説明が必要で、免疫指標とクリニカルアウトカムをつなげる外 挿性の説明が必要である(あるいは説明できる免疫指標を測定し、科学的な合理性の記載が必要である)。
健康産業新聞記事引用
抗加齢協会HP引用
人を対象とする生命科学・医学系研究に関する倫理指針の解釈他(その2)
2021.07.29
20201年6月30日より執行された「人を対象とする生命科学・医学系研究に関する倫理指針」(新倫理指針)については、改定前の指針がより具体化された内容ではあるものの、解釈の仕方に委ねられる不明確な点があることも事実であり、特に特定保健用食品や機能性表示食品の臨床試験については、明確化されていない点も多く、厚生労働省の担当者自身も、これからの改定により、明確にする必要がある部分は多いとコメントしている。
この状況において、何をもって食品臨床試験のサイエンスとしての品質を担保するかについての質問を受け、厚生労働省担当者のコメントは、「最終的には、論文投稿時の査読者が、当該試験の投稿の可否を判断することで、品質が担保されるもの」とのことであった。
今回、改めて 結果の公表(6 研究終了後の対応 ― ⑵ 研究責任者は、研究を終了したときは、遅滞なく、研究対象者等及びその関係者の人権又は研究者等及びその関係者の権利利益の保護のために必要な措置を講じた上で、当該研究の結果を公表しなければならない。)について、厚生労働省担当者のコメントは、「指針はあくまで指針であり、具体的な結果公表方法の是非については、指針を踏まえた倫理委員会が判断するもの。」とのことであった。試験実施(依頼)企業のHPに結果を掲載することによる公表案について質問したところ、あくまで倫理委員会が判断するとの前提の上で、否定はしなかった。
特に特定保健用食品や機能性表示食品の臨床試験においては、開発期間、商品サイクルの短さ等、諸事情により、結果の公表が現実的に困難な場合もあり、今回の指針の意図を理解したうえで、現実的にどのように対応するかについては、試験実施(依頼)企業の判断が迫られるところである。
◆6 研究終了後の対応(倫理指針より抜粋)
⑵ 研究責任者は、研究を終了したときは、遅滞なく、研究対象者等及びその関係者の人権又は研究者等及びその関係者の権利利益の保護のために必要な措置を講じた上で、当該研究の結果を公表しなければならない。
■ガイダンスより抜粋
⑵の規定は、研究の結果の公表について定めたものである。ゲノム指針においては研究の透明性の確保が研究者等の責務であり、研究結果の公表はその手段として例示されていた。この指針においては研究の透明性を確保するという観点から、この指針が適用される全ての研究に関して、研究結果の公表を求めている。
人を対象とする生命科学・医学系研究に関する倫理指針の解釈他
2021.07.14
20201年6月30日より執行された「人を対象とする生命科学・医学系研究に関する倫理指針」(新倫理指針)については、改定前の指針がより具体化された内容ではあるものの、解釈の仕方に委ねられる不明確な点があることも事実であり、特に特定保健用食品や機能性表示食品の臨床試験については、明確化されていない点も多く、厚生労働省の担当者自身も、これからの改定により、明確にする必要にある部分は多いとコメントしている。
この状況において、何をもって食品臨床試験のサイエンスとしての品質を担保するかについての質問を受け、担当者のコメントは、「最終的には、論文投稿時の査読者が、当該試験の投稿の可否を判断することで、品質が担保されるもの」とのことであった。
また、食品臨床試験に関係する用語の解説として、あくまで一般的にとの前置きのうえで、「研究機関及び協力研究機関については、基本的には医療機関を想定しており、企業(依頼者、SAMO、CRO)を指すものではない。協力研究機関の例としては、CT検査を外部医療機関に委託するケースなどが当たります。」との解説があった。
■ガイダンスより抜粋 P14 「第2用語の定義」
(10)研究機関
研究が実施される法人若しくは行政機関又は研究を実施する個人事業主をいう。
ただし、試料・情報の保管、統計処理その他の研究に関する業務の一部についてのみ委託を受けて行われる場合を除く。
(11)共同研究機関
研究計画書に基づいて共同して研究が実施される研究機関(当該研究のために研究対象者から新たに試料・情報を取得し、他の研究機関に提供を行う研究機関を含む。)をいう。
(12)研究協力機関
研究計画書に基づいて研究が実施される研究機関以外であって、当該研究のために研究対象者から新たに試料・情報を取得し(侵襲(軽微な侵襲を除く。)を伴う試料の取得は除く。)、研究機関に提供のみを行う機関をいう。
(13)試料・情報の収集・提供を行う機関
研究機関のうち、試料・情報を研究対象者から取得し、又は他の機関から提供を受けて保管し、反復継続して他の研究機関に提供を行う業務(以下「収集・提供」という。)を実施するものをいう。
(14)多機関共同研究
一の研究計画書に基づき複数の研究機関において実施される研究をいう。
機能性表示食品の届出受理件数
2021.05.10
2020年度に受理された機能性表示食品は、1,007品目(4月14日受理)となりました。
20年度は緊急事態宣言の影響で、4月の受理数は63品となり、前年同月の82品を下回っていたが、その後は順調に受理が進み、7月には117品の受理を記録し、結果として2019年度実績の882品を超えて、今回1,000品目の大台を達成。(機能性表示食品制度開始の15年度:310、16年度:620、17年度:452、18年度:690となっている。)機能性表示食品制度開始以降、これまで行われた届出総数は3,961品。このうち413品の届出が取り下げられ、4月14日時点の受理総数は3,548品となっています。
これらを機能性表示別に見ると、体脂肪や中性脂肪などの「脂肪系」が約15%で最も多く、次に「整腸+血糖」「コレステロール+中性脂肪」といった、特定保健用食品でみられる表示を複数表示するものが約13%。それ以降は、「睡眠・ストレス・疲労」、「血圧」、「整腸」、「肌」、「認知機能」、「眼機能(アイケア)」、「関節・筋肉・歩行」、「血糖」の順になっており、また「免疫」や「排尿」、また「血管の弾力」といった新規ヘルスクレームの品目も受理されています。
弊社では、特定保健用食品にてヘルスクレームになっている、体脂肪、中性脂肪、血圧、整腸、血糖(食後血糖含む)や、「認知機能」や「疲労」、「眼機能」、「筋肉・歩行」、「排尿」、「免疫」「肌(保湿・弾力・紫外線)」や「血管弾力」を指標とした臨床試験を実施することが可能です。先行で受理されている機能性表示食品の届出データがベースですが、様々な評価系があるため他社とは違うヘルスクレームにしたいといったご要望にも対応可能です。
また新規ヘルスクレームにチャレンジできるような試験系も多数ありますので、ぜひお問い合わせください。
第3回特定保健用食品制度(疾病リスク低減表示)検討会
2021.04.01
消費者庁は、3/19に開催された「第3回特定保健用食品制度(疾病リスク低減表示)検討会」にて、米国・カナダ・EUで認められている類型別の表示例をベースに議論した。今後については、類型ごとの方向性、許可文言の柔軟性、申請プロセスの効率化、先行申請者の権利保護について検討を進める見通し。
■類型別表示概要
類型1.摂取量を減らすことによる表示
この類型は、「高血圧のリスクを減らす可能性のある低ナトリウム食の一部になり得る」のように、食品中のある成分の摂取量を減らすことと疾病リスクの低減の関係を表示するものである。多くの委員から、食品を通じて関与成分を積極的に摂取することで特定の保健の目的を期待するというこれまでのトクホの運用を前提とすると、この類型は、トクホの制度になじまないのではないかとの意見が出された。
類型2.現行のトクホ(疾病リスク低減表示)制度に沿った表示
この類型は、カルシウム、ビタミン D の摂取と骨粗鬆症等の疾病リスクの低減の関係を表示するものである。海外においてはサプリメントを用いた介入試験のデータがあるものの、その合成量は緯度等の様々な要因によって大きく左右されるため、海外のデータをそのまま日本に当てはめることは難しいとの意見が出された。
類型3-1.既許可のトクホに類似の表示(疾病リスクを低減する旨の直接的な表示)
この類型は、非う蝕性糖質甘味料等を含む食品において、虫歯のリスクを低減する旨を直接的な表現で表示するものである。多くの委員から、この類型を疾病リスク低減表示として具体的に検討していくことは妥当であるが、検討に当たっては、科学的根拠の確認だけでなく、消費者に対し歯磨きの重要性や当該食品の適切な使用方法等について適切に情報提供が行われることが適当との意見が出された。
類型3-2.既許可のトクホに類似の表示(疾病の代替指標の取扱い)
この類型は、疾病と疾病の代替指標(バイオマーカー)※の関連性とともに、特定の成分とバイオマーカーの関連性を表現することで、疾病リスク低減に資することを表示するものである。
※ 例:冠状動脈性心疾患と LDL コレステロール
国民のヘルスリテラシーと消費者教育に大きく貢献ができるとの観点から、「診断に用いるバイオマーカー」と「疾病リスク」の関係が「公知の事実」となっている場合は、既許可表示に定型文を付加した「疾病リスク低減表示」への一律移行を導入してはどうかとの意見があった。一方、特定の成分が疾病のリスクを低減することの十分な科学的根拠が必要であるとの意見、栄養以外の要因への注意を減らし適切に医療機関への受診を行わなくなるおそれがある等、多くの委員からこの類型については慎重に取扱うべきとの意見が出された。
類型4.対象成分が限定されていない表示
この類型は、対象成分を限定せず、果物、野菜等を含む食品について心疾患等の疾病のリスクを低減する旨を表示するものである。多くの委員から疾病リスク低減表示というよりは食育の範囲ではないか、トクホの制度にはなじまないのではないかとの意見が出された。
拡大するヘルスクレーム
2021.03.25
2020年度に発売された健康食品・保健機能食品の45%が機能性表示食品となっており、ここ数年市場の3割ほどで推移していたが、19年、20年と増加傾向にある。機能性表示食品の届出件数は現在、累計3,817件となっており、4,000件まで目前にきている。最近届出された機能性表示食品のヘルスクレームでは「血糖値+中性脂肪」と複数表示を行うものが多く、「肌の保湿機能」や「紫外線刺激からの肌保護機能」といった効果を訴求する商品が目立ってきました。
新規ヘルスクレームとしては、昨年は排尿や免疫能が大きなトピックスとなりました。排尿は「トイレが近いと感じている女性の日常生活における排尿に行くわずらわしさをやわらげる機能があると報告されています。」となっており、排尿回数の減少についてではなく、あくまで生活の質がやわらげられることを訴求しています。
また今年1月には「肌の弾力維持」が受理されました。ヘルスクレームは、「抗酸化作用を持つアスタキサンチンは、肌の水分量と肌の弾力を維持することで、肌の健康を守るのを助ける機能があることが報告されています。」となっています。
今年は更に届出受理される件数は多くなることが予想されますが、新規のヘルスクレームについても出てくる可能性は十分にあると思われます。
弊社では、排尿、免疫能や肌弾力を指標とした臨床試験を実施することが可能です。先行で受理されている機能性表示食品の届出データがベースですが、様々な評価系があるため他社とは違うヘルスクレームにしたいといったご要望にも対応可能です。
また新規ヘルスクレームにチャレンジできるような試験系も多数ありますので、ぜひお問い合わせください。
新型コロナウイルスCOVID-19への対策及び対応
2021.02.01
新型コロナウイルス発生への対応及び対策については、コロナ第3波下にあって業界の最重要課題の一つであり、基準の「見える化」推進を図るべく、弊社の基準について「業界TOPICS」へ掲載致します。
※緊急事態宣言(大阪)発令を受けて改訂:2020年1月14日
第1.実施中の臨床試験について
【試験責任医師及び弊社の方針】
実施中の臨床試験については、クライアントの意向を確認し、継続の要望があれば、以下の対策を徹底のうえ実施致します。但し、政府及び地方自治体の意向又は指導により、試験責任医師と検討のうえ中止する可能性がございますが、その際にはクライアントと相談のうえ検討致します。
1.被験者への対策
1) 感染防止策として、以下について検査日迄に被験者へ通知。
ア.新型コロナウイルスへ感染した場合、原則として試験責任医師の判断により脱落とする。
イ. 以下ア)~キ)に該当する被験者は、厚生労働省の受診基準に従って対応するよう要請。
その後の経過又は受診(検査)結果により試験責任医師が試験継続の可否を判断。
ウ.検査日において、以下ア)~キ)に該当する被験者は、原則的に来院不可とする。
来院後に、以下ア)~キ)への該当が疑われる場合、検査実施の可否を試験責任医師が判断し、
検査を実施する場合は、個室にて個別検査とする。
ア)風邪の症状や37.5度以上の熱がある、又は過去14日以内に4日以上症状が出た。
イ)強いだるさ(倦怠感)や息苦しさが(呼吸困難)ある、又は過去14日以内に症状が出た。
ウ)ア)、イ)以外の発熱や咳など比較的軽い風邪の症状が4日以上続いている、又は過去14日以内に症状が出た。(症状には個人差があり、特に本人の自覚症状として強い症状の場合及び、解熱剤などを飲み続けなければならない場合。)
エ)過去14日以内に、政府から入国制限、入国後の観察期間を必要と発表されている国・地域等へ渡航した、並びに当渡航者との濃厚接触がある。
オ)過去14日以内に、新型コロナウイルスのクラスターが発生したとされる場所を当該期間に訪れ、感染者との濃厚尾接触の疑いがある。
カ)同居家族や身近な知人に感染が疑われる方もしくは感染者がいる。
キ)その他新型コロナウイルス感染可能性の症状がある。
2.試験会場及び弊社事務所での対策
1) 検温
2) マスクの着用(マスクが無い場合は配布)
3) 手洗い及びアルコールによる消毒
4) 換気の実施
5) 着席時の対人間の距離を出来る限りとる
6) 机、検査機器等の随時消毒
7) 加湿器による加湿
8) 被験者の滞在時間の短縮(アンケート等の郵送による実施、WEB活用等)
3.弊社社員及び、試験実施施設の関係者、試験スタッフへの対策
上記1‐1)‐(ウ)‐ア)~キ)に該当する場合、出勤不可とし、厚生労働省の受診基準に従って対応するよう指導。その後の経過又は受診(検査)結果により出勤の可否を判断。
【試験責任医師の判断】
以上の対策及び以下1.2.を踏まえ、試験実施施設での新型コロナウイルスの感染リスクは低く、試験の実施は可と判断しております。
1.臨床試験実施施設の性質
1) 来院患者は、がんや慢性疾患の患者が主であり、急性期の風邪等、新型コロナウイルスの感染が疑われる症状の患者の来院はない。
2) 予約診療であり、患者の来院が1時間に3~4人であることにより、患者の密集は起きない。
2.臨床試験実施方法について
異なる時間帯に数名の被験者が来院することにより、被験者の密集は起きない。
【倫理委員会のコメント】
試験責任医師の判断、及び上記対策を踏まえ、試験継続についての倫理的問題はない。但し、試験への参加を継続するか否かについては、自由意志であることを伝えたうえで、被験者へ参加継続の意志の有無を確認するよう、コメント頂いております。
第2.新たな臨床試験の受託について
【試験責任医師及び弊社の方針】
新規の臨床試験については、出来る限り「緊急事態宣言」解除後に受託(開始)する方針ですが、臨床試験が健康の向上に資するものであることも踏まえ、早期の実施が必要か否かについて、クライアントと双方で検討のうえ、必要と判断されれば、上記対策の徹底及び以下1.2.について検討のうえ実施致します。
但し、「緊急事態宣言」解除後であっても、政府及び地方自治体の意向又は指導により、受託出来ない可能性があります。
1.被験者の密集が発生する臨床試験については、十分な対人間距離を保てる試験会場の使用を検討。
2.クライアントより、更なる感染予防対策の要望があれば、検討のうえ実施。
コロナ禍における健康食品の需要
2021.01.12
2020年は、新型コロナウイルスの感染拡大により激動の1年となりました。日本でも史上初の緊急事態宣言の発令や外出自粛要請、営業自粛要請という未曾有の事態に、皆さんのライフスタイルも大きな変化が起こったのではないでしょうか。経済への打撃も大きく製造業や観光業など様々な分野に影響を与える一方で、この新型コロナウイルスを背景にして健康食品の売り上げは好況をキープしているようです。
米国の業界誌NBJの推計では、2020年のサプリメント世界市場は前年比9.5%増、額にして1500億ドル超と報告され、健康食品のニーズは世界規模で高まっているのがわかります。日本においても、総務省の調査によると2人以上世帯のサプリ支出は2020年1〜10月累計で前年比11%増と2ケタの伸びを示し、健康食品への注目が大幅に上昇していることが推察されます。さらに、日本通信販売協会(JADMA)の調査によると、2020年上半期の通信販売による健康食品の売上高は、1月が前年比0.8%減(124億7300万円)、2月が同比0.9%減(125億3200万円)、3月が同比2.2%減(133億2500万円)とほぼ横ばいを推移したのに対し、4月以降には、4月が同比9.9%増(141億5,500万円)、5月は同比6.3%減(130億1,300万円)、6月は同比12.7%増(141億5,200万円)と変動幅が拡大傾向を示しました。4月は緊急事態宣言が発動された月、つまり“国家的緊急事態”となった4月を皮切りに健康食品の売り上げが大きく動き始めていることを示しているのです。
コロナ禍で身についた新習慣は生活のいたるところにまでおよび、我々は「健康維持の重要性」を再認識させられました。まずは感染症そのものを回避するための免疫力の強化。キリングループが展開するiMUSEブランドには「免疫機能の維持」が表示され、コロナ禍における話題をさらっています。他にも需要が高まるヘルスベネフィットには、外出自粛で在宅時間の増加に伴うストレスの緩和、テレワークによるパソコン作業の増加を背景にアイケアや睡眠の質の改善など、コロナ禍だからこそのヘルスベネフィットの需要が高まっており、FANCLの展開する商品、一時的な精神ストレス緩和機能を訴求した「ストレスケア」や、目の疲労感を緩和する「ブルーベリー ミエルネ」「えんきん」なども堅調な売り上げを推移しています。
海外ではワクチン摂取が始まったものの、相次ぐ変異種の出現に未だ終息の時期が見通せない新型コロナウイルス。2020年は人々の生活様式が一変したニューノーマル元年となりました。年が明け2021年。その新たな常識の一部に「健康食品」が定着する時代に突入しています。
新型コロナウイルスCOVID-19への対策及び対応
2020.12.10
新型コロナウイルス発生への対応及び対策については、コロナ第3波下にあって業界の最重要課題の一つであり、基準の「見える化」推進を図るべく、弊社の基準について「業界TOPICS」へ掲載致します。
※大阪府独自基準にて「非常事態(レッドステージ)」移行(2020/12/3)を受けて2020/12/4改訂
第1.実施中の臨床試験について
【試験責任医師及び弊社の方針】
実施中の臨床試験については、クライアントの意向を確認し、継続の要望があれば、以下の対策を徹底のうえ実施致します。但し、政府及び地方自治体の意向又は指導により、試験責任医師と検討のうえ中止する可能性がございますが、その際にはクライアントと相談のうえ検討致します。
1.被験者への対策
1) 感染防止策として、以下について検査日迄に被験者へ通知。
ア.新型コロナウイルスへ感染した場合、原則として試験責任医師の判断により脱落とする。
イ. 以下ア)~カ)に該当する被験者は、厚生労働省の受診基準に従って対応するよう要請。
その後の経過又は受診(検査)結果により試験責任医師が試験継続の可否を判断。
ウ.検査日において、以下ア)~カ)に該当する被験者は、原則的に来院不可とする。
来院後に、以下ア)~カ)への該当が疑われる場合、検査実施の可否を試験責任医師が判断し、検査を実施する場合は、個室にて個別検査とする。
ア) 風邪の症状や37.5度以上の熱がある、又は過去14日以内に4日以上症状が出た。
イ) 強いだるさ(倦怠感)や息苦しさが(呼吸困難)ある、又は過去14日以内に症状が出た。
ウ) 過去14日以内に、政府から入国制限、入国後の観察期間を必要と発表されている国・地域等へ渡航した、並びに当渡航者との濃厚接触がある。
エ) 過去14日以内に、新型コロナウイルスのクラスターが発生したとされる場所を当該期間に訪れ、感染者との濃厚接触の疑いがある。
オ) 同居家族や身近な知人に感染が疑われる方もしくは感染者がいる。
カ) その他新型コロナウイルス感染可能性の症状がある。
2.試験会場及び弊社事務所での対策
1) 検温
2) マスクの着用(マスクが無い場合は配布)
3) 手洗い及びアルコールによる消毒
4) 換気の実施
5) 着席時の対人間の距離を出来る限りとる
6) 机、検査機器等の随時消毒
7) 加湿器による加湿
3.弊社社員及び、試験実施施設の関係者、試験スタッフへの対策
上記1‐(1)‐(ウ)‐ア)~カ)に該当する場合、出勤不可とし、厚生労働省の受診基準に従って対応するよう指導。その後の経過又は受診(検査)結果により出勤の可否を判断。
【試験責任医師の判断】
以上の対策及び以下1.2.を踏まえ、試験実施施設での新型コロナウイルスの感染リスクは低く、試験の実施は可と判断しております。
1.臨床試験実施施設の性質
1) 来院患者は、がんや慢性疾患の患者が主であり、急性期の風邪等、新型コロナウイルスの感染が疑われる症状の患者の来院はない
2) 予約診療であり、患者の来院が1時間に3~4人であることにより、患者の密集は起きない。
2.臨床試験実施方法について
異なる時間帯に数名の被験者が来院することにより、被験者の密集は起きない。
【倫理委員会のコメント】
試験責任医師の判断、及び上記対策を踏まえ、試験継続についての倫理的問題はない。但し、試験への参加を継続するか否かについては、自由意志であることを伝えたうえで、被験者へ参加継続の意志の有無を確認するよう、コメント頂いております。
第2.新たな臨床試験の受託について
【試験責任医師及び弊社の方針】
新規の臨床試験については、出来る限り「レッドステージ」解除後に受託(開始)する方針ですが、臨床試験が健康の向上に資するものであることも踏まえ、早期の実施が必要か否かについて、クライアントと双方で検討のうえ、必要と判断されれば、上記対策の徹底及び以下1.2.について検討のうえ実施致します。
但し、「レッドステージ」解除後であっても、政府及び地方自治体の意向又は指導により、受託出来ない可能性があります。
1.被験者の密集が発生する臨床試験については、十分な対人間距離を保てる試験会場の使用を検討。
2.クライアントより、更なる感染予防対策の要望があれば、検討のうえ実施。
以上
免疫機能を維持する食品
2020.11.09
機能性表示食品制度が新たなステージに突入しています。
2015年にスタートした機能性表示食品ですが、約30年の歴史を誇る“トクホ”を遥かに上回り、わずか5年で受理数3000品に到達しました。年度別では15年度が310品、16年度は620品と順調に伸ばし、17年度には452品と一旦スタートダッシュを終えましたが、18年度は690品、19年度は882品、そして20年度は10月時点で422品と、その勢いはとどまることを知りません。
ハイペースで受理数を伸ばす中、今最も話題となっているのは今年8月に受理されたプラズマ乳酸菌を関与成分とするキリングループのiMUSEブランド5商品。それらに表示された機能性は、なんと「免疫機能の維持」。業界にとって悲願であった“免疫での受理”を達成し、本制度の歴史における新たな1ページを刻むことになりました。
現在、“免疫”と聞いて真っ先に思い浮かぶのは“新型コロナウィルス”ではないでしょうか。今年はこの“新型コロナウィルス”によって世界中が錯綜しました。そして今もなおその感染に怯え、閉塞感の広がる日々を粛々と送っています。イギリス、アメリカ、中国を筆頭にワクチン開発が急ピッチで進められていますが、いまだ臨床試験を実施している段階で安全性や有効性については全く確立されていません。つまりコロナにかからないための感染予防が必要なのです。私たちが今できる感染予防策、それは手洗いとうがいです。政府やメディアの影響で手洗い・うがいは日本人の“当たり前習慣”となりました。ですが、“STAY HOME”も当たり前となった現在では、外出の機会も減り、帰宅後の手洗い・うがいよりも“免疫力の強化”の方に注目が集まっています。コロナ禍での免疫ニーズの高まりから、「免疫機能の維持」と表示された商品は、飛躍的に売れ上げを伸ばすことになるのでしょう。
キリンビバレッジおよびキリンホールディングスから間を置かずに、ファンケル、小岩井乳業も届出が受理され、現在では4社10商品において「免疫機能の維持」が表示されています。そして今後も各社が免疫での機能性表示を目指し、それにより機能性表示食品の受理数も依然としてハイペースが予想されます。新たな市場を拡大した業界初の“免疫での届出受理”。与えたインパクトも大きく、コロナ禍で免疫機能の強化を意識する消費者に対し猛アピールすることになりました。今後、プラズマ乳酸菌に続く次の関与成分の登場も予想され、われわれ消費者の期待はますます膨らんでいきます。
機能性表示食品 免疫機能表示製品
2020.09.09
■食品と開発(2020/8/124より引用)
「機能性表示食品で初、免疫機能を表示した製品が受理」
機能性表示食品で、キリンビバレッジの「キリン iMUSE(イミューズ)水」など5品が、免疫機能の表示で受理された。消費者庁は機能性表示食品の受理製品についてホームページで発表しており、8月7日更新分で受理されたことが分かった。
関与成分は、プラズマ乳酸菌(L. lactis strain Plasma)で、摂取目安量あたりの含有量は1000億個。表示は「本品には、プラズマ乳酸菌(L. lactis strain Plasma)が含まれます。プラズマ乳酸菌はpDC(プラズマサイトイド樹状細胞)に働きかけ、健康な人の免疫機能の維持に役立つことが報告されています。」となっている。
受理製品は、
キリンビバレッジ (以下3品は清涼飲料水)
・キリン iMUSE(イミューズ) 水
・キリン iMUSE(イミューズ) レモン
・キリン iMUSE(イミューズ) ヨーグルトテイスト
キリンホールディングス(以下2品はサプリメント)
・キリン iMUSE professional(イミューズ プロフェッショナル)プラズマ乳酸菌サプリメント
・キリン iMUSE(イミューズ) プラズマ乳酸菌サプリメント
製品への表示は「健康な人の免疫機能の維持をサポート[プラズマ乳酸菌の研究報告]」となっている。
研究レビューで機能性を評価し、文献の検索は5つのデータベースを用いて実施し、調査対象となる文献は6報。
・pDCへの作用についての文献6報のうち、3報でpDC活性化を示す指標が対照群と比較して有意に高値であった。
・体調に関する全身の自覚症状についての文献6報のうち、4報で全身の自覚症状(全身倦怠感、寒気、熱っぽさ、総合的な臨床症状、体調または疲労)が対照群と比較してより軽度に維持されていた。
・体調に関する特定の部位の自覚症状についての文献5報のうち、全てで特定の部位の自覚症状(くしゃみ、鼻汁、鼻閉、のどの痛み、せき、頭痛、関節痛または筋肉痛)が対照群と比較してより軽度に維持されていた。
これらを総合的に判断し、L. lactis strain Plasmaの免疫機能の維持効果について示唆的な根拠があると判断された。
肌分野への新規参入
2020.08.01
機能性表示食品が2015年のスタート以降、累計数2,989品となりました。2019年度の受理数は882品、前年度比28%増で過去最高を更新しています。機能性別に見ると過半数が、「体脂肪、血圧、血糖値」などの「従来トクホ型」で「ストレス、疲労」「認知機能」「肌」などがそれに続きます。関与成分では「GABA」が、これまで最も多かった「難消化性デキストリン」を抜いて290品と最多、抜かれた「難消化デキストリン」も288品であり、この2トップに「EPA・DHA」「イチョウ葉」などが続いています。運用5年目にして受理事業者数は743者、そのうち200者が2019年度の新規受理事業者でした。数字からも昨年度の勢いが窺い知れます。消費者への認知度はなかなか上がらないものの、今年の市場は3,007億円と予想され、3,400億円のトクホ市場を脅かす存在にまで成長しました。そんな機能性表示食品の中に、一つの素材で複数のヘルスクレームに成功する例があります。
三和酒類株式会社のサプリメント「リフティングGABA」が機能性表示食品として受理されました。「GABAには、肌の弾力を維持し、肌の健康を守るのを助ける機能があることが報告されています。肌の乾燥が気になる方に適しています。」と表示され、GABAでは初となる「肌弾力の維持」を謳っています。麦焼酎「いいちこ」が全国的にも有名な三和酒類は、焼酎、清酒、ワイン、ブランデーなど幅広く手がける総合醸造企業ですが、同社はその焼酎の醸造過程で得られる副産物の有効利用として、機能性素材「大麦乳酸発酵液ギャバ」を独自に開発しています。
この素材は、すでに「睡眠の質の向上」「疲労感・ストレス」「活気・活力」「血圧調整」の4つの機能性で受理実績がありましたが、今回「リフティングGABA」が受理されたことで、5つの機能性を持つ素材となったのです。これまで、肌分野での機能性表示は「潤い」や「保湿」に関するものが多くを占め、他社との差別化に頭を悩ませる状況でした。GABA配合で「肌の弾力」を謳える商品開発が可能になったことで、現時点での受理数最多「GABA」を関与成分とした機能性表示食品が、今後ますます活性化することは間違いないでしょう。そして三和酒類もこの受理実績を持って、新市場の開拓に大きく乗り出すことが予想されます。
最近は、男女を問わずスキンケアへの関心が高まっています。機能性別でも肌分野は7%と決して大きくはなく、新規参入での勝機には充分な余地があると言えるでしょう。弊社では肌弾力を評価する臨床試験も受託しております。まずはご相談、お問い合わせを心よりお待ちしております。
新型コロナウイルス対応策及び、訪問型食品臨床試験の検討
2020.07.01
新型コロナウイルス発生による緊急事態宣言の解除後、今後同様の事態を想定して、被験者・試験関係者の保護及び社会的責任・倫理への対応が、CROとしての目下の課題となっています。
被験者保護に関しては、被験者・試験関係者への感染予防対策の徹底、及び緊急事態宣言発令中の試験参加継続についての被験者の自由意思の再確認が必須と考えます。
また、社会的責任・倫理への対応については避けられない問題であり、試験依頼者、責任医師、CRO間で随時検討のうえ、対応する必要があります。
弊社では、責任医師及び倫理委員会と検討のうえ、CROとしての自主基準を策定しておりますが、更に改定を進めております。
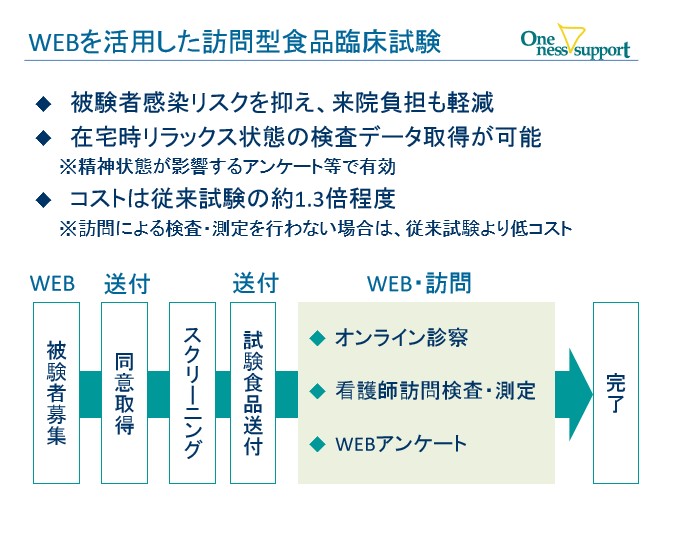
また、長期的対応策として、訪問型の試験について業界として取り組んで行く必要性があるものと考えています。オンライン診察、訪問看護師による検査・測定、ウエアラブルデバイスの導入等により、欧米を中心に広がりつつあるバーチャル治験の応用が理論上は可能であります。
但し、国内の医薬品治験においてもまだ準備段階であることも踏まえたうえで、種々の課題への対応が求められます。
日本では電子的同意は認められていないので、同意説明文書の郵送及び、オンラインによる説明での同意取得等の対応が必要となります。
訪問看護師の教育と訪問時の感染予防対策、コストアップ等の課題がありますが、被験者の感染リスクを抑えること、及び来院負担がなくなることで、被験者により配慮した試験を実施できるメリットがあり、実現に向けて準備を進めております。
「免疫力強化」でウィルス対策
2020.06.01
新型コロナウィルスによる肺炎(COVID-19)が世界中で猛威を振るっています。感染者数は全世界で471万人に達し、うち31万もの尊い命が、この未知のウィルスによって奪われました。(5月18日現在)。日本でも4月7日、史上初となる「緊急事態宣言」が発令され、東京、大阪などの都市部を中心に、感染者数の拡大が続いています。多くの専門家が、逼迫する医療現場を危惧する中、私たちが自らの命を守るために必要な対策とは一体何なのでしょうか。
日本を含む世界各国の大手製薬メーカーは、COVID-19の治療薬およびワクチン開発に乗り出しました。いち早く開発に成功すれば、世界の市場を掌握できるとあって、各メーカーとも、その動きに加速を見せています。しかし、実用化されるまでの壁は高く、国境を超えた開発協力と莫大な資金が必要であり、さらに副作用リスクの存在も懸念すると、研究は一筋縄ではいきません。どんなに早くても12ヶ月から18ヶ月を要すると想定され、開発実現は予断を許さない状況となっています。
COVID-19は、感染したすべての人が発症するわけではありません。感染予防には「外出を自粛する」「マスクを着用する」「うがい、手洗い」などの基礎的な手段で対応しますが、発症を防ぐという観点からは「免疫力を高める」という手段も有効な手段の一つかもしれません。
機能性表示食品制度に新たな動きが見られました。同制度では、「免疫を賦活する」「免疫力アップ」などの直接的な表現は認められていませんが、消費者庁は「免疫はNGワードではない」と明確に示し、さらに政府の3月閣議決定には「機能性表示食品等で科学的知見の蓄積を進め、免疫機能の改善等を通じた保険用途における新たな表示の実現を目指す」と盛り込まれました。つまり、従来通り限られた指標のみでの免疫表示は不可としつつも、明確な科学的根拠に基づく「免疫表示」を政府自らが推進しているのです。
現在、このコロナ禍で多くの国民が「免疫」に注目しています。当社では、この「免疫機能」を評価する臨床試験を受託しております。試験デザインの提案から届出受理に至るまでトータルにサポートしております。まずはご相談から、是非ともお問い合わせください。
機能性表示食品「事後チェック指針」運用開始
2020.05.01
消費者庁は、機能性表示食品に対する透明性確保のため、「事後チェック指針」を策定。4月1日から運用を開始する。以下、「第1 機能性表示食品の科学的根拠に関する事項-科学的根拠として明らかに適切とは考えられない具体例」について抜粋。
(1)最終製品を用いた臨床試験(ヒト試験)及び研究レビューに共通する事項
ア) 届出資料において、表示する機能性に見合ったリサーチクエスチョンは設定されているが、表示の内容が、科学的根拠の内容に比べて過大である、又は当該根拠との関係性が認められない場合
【例】
・主要アウトカム評価項目において表示する機能性についての有意な結果が得られていないもの。
・表示する機能性について、主要アウトカム評価項目が複数設定されている場合であって、一部のアウトカム指標で有意な結果が得られているが他のアウトカム指標では有意な結果が得られていないときに、その関連性を踏まえた説明がされないもの。
イ) 限定的な条件下での結果であり、条件を限定しない場合には特定の保健の目的が期待し難いと考えられる結果であるにもかかわらず、表示の内容では当該条件に何ら言及していないもの。
ウ) 根拠論文が撤回され、機能性表示の科学的根拠となる査読付き論文が存在しなくなった場合。
エ) エキス及び分泌物に含有される特定の成分を機能性関与成分としているものであって、当該特定の成分のみでは表示する機能性を根拠論文等により合理的に説明できない場合。
オ) エキス等を機能性関与成分とする場合において、指標成分が機能性関与成分たるエキス等との同等性を確保できることについて、合理的に説明できない場合。
カ) 根拠論文の対象者の一部に疾病に罹患している者が含まれる場合に、適切な層別解析がなされず、疾病に罹患している者が除外できていない場合。(ガイドラインの例外的に軽症者を除く。)
(2)最終製品を用いた臨床試験
ア) 試験の実施計画又は実施方法に不備がある場合。
【例】
・臨床試験の計画が、ガイドラインに規定する登録システムに事前登録されていない場合。(1年を超えない日までに開始された研究を除く。)
・UMIN 臨床試験登録システム等への事前登録後に、機能性の実証に係る項目(主要アウトカム評価項目、副次アウトカム評価項目、試験デザイン、介入、適格性、統計解析方法等)に関して適切な手続を経ずに実質的な変更を行った研究である場合。
・倫理審査委員会の承認を受けていない場合。
・プラセボ食等を摂取する対照群が設定されていない場合。
・介入群に評価指標が高値又は低値の者が恣意的に割り振られている等、介入群と対照群で適切な参加者の割り付けが行われていない場合。
イ) 試験結果の評価に不備がある場合
【例】
・主要アウトカム評価項目における介入群と対照群の群間比較で統計的な有意差(5%)が認められていない場合。
・評価指標について、当該分野の学術的なコンセンサス等の観点から当該機能性を評価する指標として合理的な説明がされない場合。
・評価指標に主観的な指標を用いる場合、日本人への妥当性が得られたものであり、かつ、当該分野において学術的に広くコンセンサスが得られたものであることについて合理的な説明がされない場合。
(3)最終製品又は機能性関与成分に関する研究レビュー
ア)研究レビュー結果の客観性・透明性を担保するために必要な資料について下記の情報等に関し客観性・透明性が担保されない場合。
【例】
・論文の検索条件や採択
・不採択の論文情報等、結論に至るプロセス
・当該研究レビューにおけるスポンサー、共同スポンサー(研究の発案、運営及び資金の全て又はいずれかに責任を負う個人、企業、研究機関又はその他の団体)及び利益相反に関する情報
・出版バイアスの検討結果
イ) 研究レビューで採用した論文(臨床試験(ヒト試験)の内容(試験デザイン、試験方法、対象者、結果の評価等))について不備がある場合
【例】
・RCT(ランダム化比較試験)で表示する機能性を支持する査読付き論文が1報もない場合。
・表示する機能性に見合ったアウトカムを適正に研究レビューへ反映せず、肯定的な結果のみを恣意的に選出している場合。
ウ)研究レビューにおける成分と届出食品中の機能性関与成分との同等性が担保されない場合。
【例】
・研究レビューで評価した成分(エキス等を含む。)と届出食品中の機能性関与成分の同等性(含有量、フリー体又は塩若しくはエステル体等の別、基原を表示する場合にはその基原、エキス等の場合は抽出方法や製法等)が合理的に説明されない場合。
・研究レビューで有効性が確認された量よりも届出食品中の機能性関与成分の含有量が少ない場合。(ガイドラインに基づき機能性が報告されている一日当たりの機能性関与成分の量に占める割合を表示する生鮮食品を除く。)
・研究レビューで有効性が確認された際の摂取時の形態や剤型と届出食品での形態や剤型が異なる場合において、有効性が確認された機能性関与成分の有効量の同等性が合理的に説明されない場合。
エ) 「totality of evidence」の判断(採用論文数、最終的に肯定的と判断できる要素等)が適切になされているとはいえない場合。
【例】
・バイアスリスクを著しく過小評価した論文を基に、肯定的な結論を導き出している場合。
・表示する機能性に対し否定的な結論である論文のデータを恣意的に除いてメタアナリシスを実施している場合。
・表示する機能性について総合的に肯定されるとの判断をするに至った合理的な理由が具体的に示されない場合。
・表示する機能性を支持する査読付き論文が1報もない場合。
・結果の客観性・透明性を担保するために必要な情報が示されない場合。
紫外線から「肌を保護」
2020.04.01
美容意識の高い人にとって、当たり前でとても重要なスキンケア。肌の老化は加齢によるものが2割程度、残りの8割は外的刺激によるものといわれています。その外的刺激の中でも最大の敵は紫外線でしょう。帽子やサングラス、マスク、アームカバーなど外出時の紫外線対策アイテムは多様にありますが、徹底的に身を守ろうとするあまり少々過剰気味な装いの人も見かけます。
抗紫外線作用を謳った機能性表示食品があるのをご存知でしょうか。昨年5月に届け出された富士フィルムの「アスタリフト ホワイト ドリンク ホワイトシールド」という清涼飲料水です。関与成分は「アスタキサンチン」で、同年12月にはサプリメントとしても届出されています。届出表示は「本品にはアスタキサンチンが含まれます。抗酸化作用を持つアスタキサンチンは、紫外線刺激から肌を保護するのを助ける機能性、紫外線を浴びた肌を乾燥から守り、肌のうるおいを守る機能性が報告されています。」これは研究レビューにて検証された「MEDの上昇 (紫外線刺激における紅斑の抑制)」を消費者向けに「紫外線刺激から肌を保護するのを助ける」とわかりやすく表現されています。
美容関心層が求める機能性は肌の潤い(保湿作用)だけではありません。「肌を保護する」というワードには間違いなく反応を示すでしょう。購買ターゲットとなるのは主に女性全般ですが、近頃では若年男性のスキンケアも常識になりつつあります。もとより化粧品市場で最も大きなカテゴリーのスキンケア市場は、今後ますます拡大していくと予想されます。
富士フィルムに次いで、昨年11月には明治の「明治スキンケアヨーグルト 素肌のミカタ」が、12月にはグリコ栄養食品から「PapriX(パプリックス)パプリカスキンヴェール」が届出されており、昨今ブームとなっている「食べるスキンケア」を一層進展させました。このブームの波に乗ろうと数多くの商品が開発・販売されていますが、科学的裏付けがあるか否かでその格差は顕著となるのです。
弊社では、機能性表示食品対応の抗紫外線作用を評価するヒト臨床試験を実施することができます。背中に紫外線を照射し、人工的に日焼けさせた部位を分光測色計により肌の紅斑(MED)や黒化(シミ)を数値化し、食品の紫外線による肌への影響を評価します。
もし抗紫外線作用のヒト臨床試験をご検討されていれば、ぜひお問合せください。
臨床研究法の執行後の問題点とCRO・SMOの対応
2020.03.01
臨床研究法の執行により、医師主導治験の進行において様々な問題が発生しており、大手のCRO・SMOも、主に収益・コストの問題で支援業務への本格参入を見合わせている状況が続いている。
問題解決の第一歩として、JCTN:Japanese Cancer Trials Network 「臨床研究法の抜本的見直しに向けた提言」2019/5/28 「要望5」の、「いわゆる ICH-GCP 上の sponsor の概念」の導入が必須と思われる。
sponsor の概念が導入されれば、CROでの一括管理もより効率化され、CROとSMOの連携もよりスムーズに行われることにより、医師主導治験のコストに見合った支援が可能になるものと思われる。
以下~JCTN:Japanese Cancer Trials Network 「臨床研究法の抜本的見直しに向けた提言」2019/5/28より抜粋
臨床研究法の施行により、日本の研究者主導試験のアクティビティが、今後大幅に低下することが懸念されている。これらの懸念を払拭するためには、(1)コスト面での工夫(高額な認定臨床研究審査委員会の審査料や臨床研究保険の保険料への対策)、(2)運用面での工夫の双方が必要であるが、本提言は、これらのうち法改正、省令改正で期待される「(2)運用面での工夫」について、JCTN を構成する 9 グループから意見を収集し、取りまとめた。
重点要望 1
法第 2 条第 2 項第 2 号ロに規定される「適応外」の適用範囲を再審査期間中の薬剤に限定し、特定臨床研究の範囲を見直すべきである。
重点要望 2
実施計画と jRCT 登録内容を分離し、前者は厚労大臣への報告が必要なほどの重要事項のみに絞るべきである。
重点要望 3
研究責任医師や研究分担医師等によって申告された利益相反について、各医療機関の管理者が「事実関係についての確認」を行わなければならないとする施行規則第 21 条第 2 項の規定を廃止すべきである。
要望 4
施行通知(20)①の「原則として適切な保険に加入すること」という、法や省令に書かれていない踏み込んだ記載を見直すべきである。
要望 5
試験全体の運営責任、いわゆる ICH-GCP 上の sponsor の概念を臨床研究法にも導入し、全参加医療機関の合意がなければ sponsor の責務を果たすことができない現行の規定をあらためるべきである。
<理由>
この点は日本の薬機法、GCP 省令の医師主導治験に関する規定とも共通する問題であるが、国内の臨床試験実施の際のコスト高の原因となり、国際共同試験の障壁となっている根本的な問題である。
例えば、50 施設で多施設共同試験を行う場合、現在の臨床研究法では 50 の参加施設それぞれに研究責任医師が存在し、均等に試験の実施責任を負う構造となっている(研究代表医師はあくまで業務上の代表であり責任を負うわけではない)。これは GCP 省令において「自ら治験を実施しようとするもの」が各参加施設に存在するのと同じ構造である。一方で、ICH-GCP には「sponsor(試験の計画、運営、資金に責任を負う個人、会社、研究機関、団体)」の概念が存在し、sponsor が試験全体の運営責任を負うと同時に、各参加施設の investigator が自施設での実施責任を負うという構造になっている。つまり、試験全体の運営責任が日本の特定臨床研究や医師主導治験では各参加施設に分散しているのに対して、ICH-GCP では 1 つの団体や医療機関が sponsor の役割を負っていることになる。そのため、例えば有害事象報告ひとつをとっても医師主導治験では PMDA へ報告する前に全参加施設の「自ら治験を実施しようとするもの」が合意しなければならない規定となっている(ICH-GCPでは sponsor が判断すればよい)。そのため、品質管理(モニタリング)や安全性管理と最終的な管理・運営責任が一本化することにより、参加施設の負担が低下し(原則として品質管理や安全性管理の法的責任は無くなる)、試験実施を行う中央側でも効率的な運営が可能となる。
この乖離は国際共同試験を実施する際に特に顕著となり、10 か国でアカデミア主導の国際共同試験を実施する場合に、9 か国は IHC-GCP に基づいた手順書を作成すればよいが、日本だけ独自の手順書を作成しなければならないこととなっている(企業治験は GCP 省令で企業が sponsor の役割を果たして良いことになっているためこの問題は生じない)。
このことはアカデミア主導の国際共同試験を実施する際の大きな障害となっているため、この際、臨床研究法や GCP 省令の医師主導治験の規定、医学系指針も抜本 的に見直して、sponsor の概念を ICH-GCP と整合させるべきである。
要望 6
研究責任医師は、因果関係を問わず必要と思われる範囲のすべての有害事象を把握するよう、施行規則第 13 条の記載をあらためるべきである。さらに、リスクの低い、未承認・適応外の医薬品等を用いる特定臨床研究よりも、それ以外の特定臨床研究や非特定臨床研究の方が、疾病等報告の範囲が広いという施行規則第 54条の矛盾した規定をあらため、ICH-GCP にあわせ、因果関係があり、予測できない有害事象を CRB 報告対象とすべきである。
要望 7
総括報告書の CRB 審査後 1 か月以内に公表しなければならないという施行規則第 24 条の規定は、先進医療の場合には実現困難であるため期限を見直すとともに、先進医療の実施にあたっての多重審査の体制をあらためていただきたい。
要望 8
全ての不適合について速やかに実施医療機関の管理者に報告するよう定めた施行規則第 15 条の規定を見直し、GCP 省令と同様の運用とすべきである。
拡大する健脳サプリメント市場
2020.02.03
健脳サプリメントが市場で盛り上がりを見せています。
「健脳」とは「健康な脳」のことです。つまり健脳サプリメントとは脳神経領域への効果をうたったサプリメントということになります。超高齢社会となった日本の認知症患者の数は年々増え続け、厚生労働省の推計では2018年の認知症患者数は500万人を超えているとされています。さらに65歳以上の高齢者の7人に1人が認知症、今から5年後の2025年には5人1人が認知症、患者数は700万人という予想もあります。こうした状況を背景に、政府は2018年6月に「認知症施策推進大綱」を決定しました。この大綱では「認知症は誰もがなりうるもの」とし「認知症になるのを遅らせる」「認知症になっても進行を緩やかにする」という意味での「予防」の推進をしています。誰もがなりうる認知症に備え、その「予防」の分野を担う健康食品業界の責任は、これからますます大きくなると思われます。
機能性表示食品のうち、認知症予防としての「記憶力」「注意力」「計算能力」を表示した品目は、現在までに225品目、一年前と比較して82品目も増加しています。
これまでの認知機能に関連した健脳サプリメントは、商品を説明するという行為が足かせとなり、医家向けや訪問販売、宣伝講習販売などの対面販売が主流でした。しかし、機能性表示食品制度の開始を機に、機能性をパッケージに直接表示できるようになったことから、商品を口頭で説明するという足かせが外され、その販路は大幅に拡大しているのです。
現在ではドラッグストアにも多く陳列され、通販サイトでも容易に購入できるようになりました。販売者が売り場へ出向いて説明する必要がなくなり、逆に購入者自らが商品購入を目的に店舗へ足を運ぶのです。今後、売り手市場へと転換されていくことも大いに期待できるでしょう。
購買層においても、制度以前は当然、認知症を発症する年代の60〜70代がメインでした。しかし制度以降は、「認知症」が視野になかった40〜50代も、売り場に並んだ商品パッケージの機能性を直接目にすることにより、それを「予防」することについて関心を大きく広げているのです。
さらに最近ではTwitterやInstagramで「脳活」「ブレインフード」などのワードが散見されるようになりました。「記憶力」、「注意力」を求めているのは高齢者だけではないようです。SNSを頻繁に活用する20〜30代の間にも健脳サプリメント・健脳食を意識するものが増えているのは確実です。全世代を取り込み始めた健脳市場、今後ますますの好調が見込まれます。
コホート研究的手法による・ランダム化比較試験のマーケティング効果
2020.01.06
機能性表示食品制度に対する消費者の認知度が年々高まってきています。まだ正確に制度の内容が消費者に伝わっているとは言い難く、これからの発展が見込まれる制度と言えます。
半面、累計届出数が2,500件を超え、機能性表示食品として届出しても他の機能性表示食品との差別化が難しくなってきていることも事実です。
2011年に、R-1乳酸菌を長期間摂取した佐賀県有田町に住む小中学生のインフルエンザ感染傾向などが紹介されました。有田町のデータでは、隣接する地区と比較してインフルエンザ(A/B/新型)の感染率が低く、統計学的に有意差があることが明らかになりました。
当時、ニュースでも話題となり、R-1乳酸菌の販売数が飛躍的に伸びたことを記憶しております。
R-1乳酸菌の事例はいわゆる「予防効果」に関するものですので、機能性表示食品や特定保健用食品としての運用は出来ません。
弊社でも、食品原料の「予防効果」に関する研究のご相談は多いのですが、景品表示表や薬機法との関係で、マーケティングに関して一様に苦労されていると感じます。
更に、臨床研究法が運用開始されたことにより、被験者を患者とする研究のハードルが期間面・コスト面でも上がっている現状を考えると、ほぼプレスリリースのみで販売促進費をほとんど掛けずに初期プロモーションに成功しているR-1乳酸菌の事例の意義は深いと感じます。
生活習慣病や認知症等、年齢が上がる毎に発症率が上がることが一般的な事実となっている症状の場合、発症率が上昇し始める年齢群に対して、
3年~10年単位/300人~1,000人規模で、コホート研究的手法でランダム化比較試験を実施し、発症率を調査・研究する場合のコストは、5000万円~数億円規模になることが見込まれますが、
マーケティングコストを考えると、特に長期的に主力の位置付けである商品の場合においては、十分な費用対効果を出すことが可能と思われます。
出典: フリー百科事典『ウィキペディア(Wikipedia)』
■ランダム化比較試験
ランダム化比較試験(ランダムかひかくしけん、RCT:Randomized Controlled Trial)とは、評価のバイアス(偏り)を避け、客観的に治療効果を評価することを目的とした研究試験の方法である。従って根拠に基づく医療において、このランダム化比較試験を複数集め解析したメタアナリシスに次ぐ、根拠の質の高い研究手法である。主に医療分野で用いられているが、経済学においても取り入れられている。略称はRCTである。
■コホート研究
コホート研究(コホートけんきゅう、英語: cohort study)とは分析疫学における手法の1つであり、特定の要因に曝露した集団と曝露していない集団を一定期間追跡し、研究対象となる疾病の発生率を比較することで、要因と疾病発生の関連を調べる観察的研究である。要因対照研究(factor-control study)とも呼ばれる。
中国の「届出制保健食品」
2019.12.11
日本では2015年にスタートした機能性表示食品制度ですが、お隣中国にもそれにあたる届出制の保健食品制度があります。従来の「食品安全法」に基づき2015年に改正公布された新食品安全法です。さらに翌年2016年には「保健食品登録および備案管理弁法」が公布され、一部の保健食品に対して届出制が開始されました。これにより中国の保健食品は認可制と届出制の二本立てになったわけですが、両者には時間とコストの面で大きな違いがあります。認可制は、60万元(900万円)以上の費用と3年以上の時間をかけ、期限付きの認可証を取得するのに対し、届出制では、30万元(450万円)ほどの費用と試験期間を含む8ヶ月程度の時間で、無期限の届出証書が取得できるのです。今年7月時点での届出受理数は中国国産品が2299品目、輸入品が55品目となっていて、輸入品の35品目は米国製品が占めています。ですがその中に日本製品は1品目もありません。これまで日本企業が保健食品の認可を取得する際には、1500万円以上の費用と5年以上の時間を要することも稀ではありませんでした。つまりハードルを低く届出制を選択することにより、中国市場への参入は比較的容易になるのです。
日本の機能性表示食品も年々順調に受理数を伸ばし、5年目を迎えた現在、2400超の品目が届出受理されています。しかしその市場性においては課題が残り、実際に流通している製品は1000以下、受理数の半分にも満たないのです。CMやドラッグストアなどで目にする機会は増えましたが、まだまだ制度自体の認知度も低く、コストと時間を費やして苦労の末に受理された製品でもさほど市場には出回っていない、というのが現状なのです。
そこで海外市場に目を向ける事は得策と言って良いでしょう。そもそも機能性表示食品制度は海外でも通用するという構想のもと作られた制度であり、各企業が機能性表示を狙って整えたエビデンスは、海外市場、先ず以って上述の中国届出制保健食品として概ね通用すると思われます。自社製品の高度化を図るには、当初から中国市場を視野に入れたプロセスを踏むことが有効なのです。
数年前、いわゆる「殺虫剤入り冷凍ギョーザ事件」や「メラニン入り粉ミルク事件」など社会を揺るがす食品安全事件が、絶えず報道されていた中国食品ですが、現在では法を整備し活用することで目覚ましい成長を遂げています。まず中国の届出制保健食品として受理を目指すことで、追って日本の機能性表示食品として受理される近道になるかもしれません。順調に規模を拡大する機能性表示食品、そして中国の届出制保健食品。日本食品業界の発展は海外なくしてあり得ないのです。
疾病リスク低減型特定保健用食品
2019.11.1
2019年4月5日、日本健康・栄養食品協会(日健栄協)は消費者庁に対し「1.疾病リスク低減型特定保健用食品の表示の拡充、およびその仕組みの拡大」に関する要望を含む「特定保健用食品の有効活用と制度の発展について」を提出した。
【要望1内容】*以下抜粋
今年度に予定されている「疾病リスク低減型特定保健用食品に関する調査事業」においては、・・・海外制度の調査も対象としていただき、疾病リスク低減表示の拡大・拡充に着手していただきたい。
【背景】*以下抜粋
・・・疾病リスク低減表示は Codex 委員会でも健康強調表示の範囲であることが規定され、欧米においても、国民の大多数を対象とした健康維持増進に関わる疾病リスク低減が検討され、申請ガイダンスが示され、その表示が数多く認められています(米国、EFSA、オーストラリア、カナダ、マレーシア、韓国、など)。
【要望2内容】*以下抜粋
・・・食品成分の欠乏症と疾病リスクの直接的関連性による規格基準型特定保健用食品の拡充に加え、バイオマーカーと疾病の関連性が専門学会などで認められている場合は、食品成分とバイオマーカー、そのバイオマーカーと疾病リスク低減の 2 段階関連性による疾病リスク低減表示を認める仕組みの導入を検討・・・
【背景】*以下抜粋
・・・例えば、日本動脈硬化学会作成の「動脈硬化性疾患予防ガイドライン」においてはバイオマーカーである LDL-コレステロールと動脈硬化性疾患リスクとの関連性が記載されており、日本糖尿病学会作成の「糖尿病治療ガイド」においては食物繊維が食後血糖コントロールや血中脂質低下に有効であることから、食物繊維を食事指導に取り入れることが記載されています。
さらに、米国 FDA の“Guidance for Industry ”には、疾病リスクの代用マーカーとして、(1)LDL コレステロール濃度、血清総コレステロール濃度、および血圧による心疾患(循環器疾患)、(2)骨密度による骨粗しょう症、(3)腺腫性大腸ポリープによる大腸がん、(4)高血糖(血糖上昇)およびインスリン抵抗性による 2 型糖尿病の使用が認められています。
これまでに疾病リスク低減型特定保健用食品として認可されたのは、カルシウムと葉酸の2つのみ。カルシウムは骨粗鬆症、葉酸は胎児の二分脊椎などの神経管閉塞障がいのリスクを軽減できる可能性を表示できる。
特定保健用食品の関連通知や行政文書では、疾病リスク低減型特定保健用食品に関する申請要件が具体的に示されておらず、カルシウムと骨粗鬆症、葉酸と神経管閉塞障がいのように規格基準となる過程についても明確にはなっていない。
今回の調査事業により、2段階関連性による疾病リスク低減表示の基準作成の推奨や個別審査型の拡大につながれば、高齢化社会の大きなニーズである疾病予防型食品のマーケット拡大につながる。また、これまで多くの指摘がなされてきた機能性表示食品制度の特定保健用食品と機能性表示食品との棲み分け問題が大きく進展する可能性もある。
機能性表示食品の届出サポート
2019.10.4
機能性表示食品制度の施行から4年半が経過し、現時点での受理件数は2350件、市場規模は2200億円にまで到達しています。受理された食品の剤型別では、錠剤やカプセルなどのいわゆるサプリメントおよび一般の加工食品がその9割以上を占めていますが、果物、野菜、鮮魚、鶏卵などバラエティーに富んだ製品も続々と受理されています。
届出を行う事業者も大手から中小はもちろん、企業だけに留まらず、青果の生産者にまで拡大を見せ、今後も異業種からの新規参入がますます増えると予想されています。特定保健用食品(トクホ)や栄養機能食品と比較しても、その参入障壁の低さこそが、わずか数年でここまですそ野を拡大できた要因だと言えるでしょう。
しかし一方では、この制度をうまく活かせていない企業もあるようです。現在までに機能性表示食品制度のガイドライン改定は4回行われており、関連する法令も含め、改定が実施された際には速やかに対応する必要があります。さらに受理数が増えることで、似通った製品が多く生まれ、他社製品との差別化に頭を悩ます企業も少なくないようです。多大な時間、コスト、労力をかけ、やっと受理に至ったとしても、直接的な売上に結びつかなければ、それは単なる無駄骨にすぎません。そこには、制度を熟知した専門家の存在が必要不可欠となってくるのです。
こういった事例に、日本健康栄養食品協会や抗加齢協会などの業界団体が実施する届出サポートが存在するほか、民間の届出支援業者も増えてきました。制度の概略を説明するサービスにはじまり、届出前の書類チェックや、効率よく届出するためのアドバイス、他社との差別化を図るヘルスクレームの提案、さらには臨床試験をコーディネートし、最終的な論文化までも含んだトータルサポートを実施する業者も存在しています。特にSR(システマティックレビュー)は、より高度な専門知識が必要であり、事業者単体で独自にやってのけることは非常に困難と言えます。
大手企業のように社内に専門の研究者が所属している、あるいは大学や研究者との間に特別な繋がりがあれば別ですが、届出を行う事業者の多くは、臨床に関する知識、スキルを持ち合わせないことがほとんどでしょう。こういった幅広いサービスを展開している民間の届出支援業者を頼り、まずはライバルたちと同じ土俵に上がることが大切です。今、目の前にある大きなマーケットは、傍観だけで済む事態ではありません。
今後、健康食品市場全体の活性化、国民の健康増進のために、届出支援業者の役割はますます重要になっていくことでしょう。
機能性表示食品 ヘルスクレームの差別化(2)
2019.9.1
参照:業界トピックス7月「機能性表示食品 ヘルスクレームの差別化(1)」
機能性表示食品の受理件数が増える毎に、機能性表示食品として受理されるだけでは、他社商品との差別化が難しくなり、ヘルスクレームの差別化により、他社商品との差別化を図る傾向が強まっています。
機能性表示食品のヘルスクレームの差別化については、いくつかの手法がありますが、今回は「機能性に関わる体内の成分や数値の変化について、作用機序の形で、具体的な成分名、指標名を届出表示に記載する手法」について観ていきます。
届出番号:D601
商品名:シャンピニオン爽粒
届出者:株式会社リコム
届出根拠:SR(採用文献1報)
■差別化のポイント
文献の作用機序の説明を記載することで、他商品との差別化を図る。
【表示しようとする機能性】
「本品にはマッシュルーム由来ポリフェノールが含まれています。マッシュルーム由来ポリフェノールには、腸内腐敗産物として知られているアンモニア、p-クレゾールを減らすことで、腸内環境を良好にすることが報告されています。」
本品の機能性については「腸内環境を良好にすること」であり、「アンモニア、p-クレゾールを減らすこと」については、明らかに作用機序としての記載です。
これまでの機能性表示食品のヘルスクレームでは、「マッシュルーム由来ポリフェノールには、腸内環境を良好にすることが報告されています。」となるのが通例です。また、機能性表示食品のガイドラインに例示される、可能な機能性表示の範囲(1)~(3)の内、(1)に反しているようにも思われます。
(1)容易に測定可能な体調の指標の維持に適する又は改善に役立つ旨
(2)身体の生理機能、組織機能の良好な維持に適する又は改善に役立つ旨
(3)身体の状態を本人が自覚でき、一時的な体調の変化(継続的、慢性的でないもの)の改善に役立つ旨
【採用文献抜粋】
・・・・・・・・・・・・・
マッシュルーム由来ポリフェノールを 0.068 ㎎/日摂取することにより、2 週間後において、腸内腐敗産物である糞便中アンモニア量と糞便中 p-クレゾール量が減少し、プラセボ群との間に群間の有意差が認められた。
・・・・・・・・・・・・・
以上のことにより、マッシュルーム抽出物 50~1000 ㎎/日(マッシュルーム由来ポリフェノール 0.068~1.36 ㎎/日)の摂取により、腸内腐敗産物であるアンモニア、p-クレゾールを減少させることが示唆された。
・・・・・・・・・・・・・
以上のことから、健常成人を対象とした試験において、マッシュルーム由来ポリフェノール 0.068~1.36 ㎎/日(マッシュルーム抽出物として 50~1000 ㎎/日)摂取することにより、「totality of evidence」の観点から腸内腐敗産物を減少させる効果に対して肯定的な結果が得られ、腸内環境が良好になることが示唆された。
・・・・・・・・・・・・・
以上の採用文献に記載されている通り、作用機序に関しての説明の部分をほぼそのまま届出表示に記載しています。今回のように、作用機序としての表現であることが明確であればヘルスクレームとして表示が可能と考えられます。
同じ「腸内環境を良好にする」でも、作用機序の説明を記載することで、他社商品との差別化を図れるという事例であり、このような差別化を図るためには、臨床試験の設計段階で投稿論文の内容を見越したヘルスクレームの開発が必要となります。
拡がる機能性表示の可能性
2019.8.5
3月26日に機能性表示食品の届出等に関するガイドラインが改正されました。昨年に続き4回目となった今回の改正では、軽症者が含まれたデータ(軽症者データ)の取扱いに関する考え方が追加されています。
そもそもこの機能性表示食品制度の示す「臨床試験(ヒト試験)」とは、特定保健用食品制度における「ヒトを対象とした試験」と同意であり、「特定保健用食品の表示許可等について」(平成26年10月30日付 消食表第259号消費者庁次長通知)の別添2「特定保健用食品申請に係る申請書作成上の留意事項」に示された試験方法に準拠することが原則となっています。その為、軽症者データの取り扱いについても、同留意事項に示されている7領域(コレステロール関係、中長期的な血中中性脂肪関係、食後の血中中性脂肪の上昇関係、血圧関係、食後の血糖上昇関係、体脂肪関係及び整腸関係)に限り、例外的に認められていました。今回の改定において、そこへさらに2領域(鼻目のアレルギー反応関係、中長期的な血清尿酸値関係)が加えられ、これらについても例外的に軽症者データの使用が認められることになりました。つまり、科学的根拠として「健常者および軽症者」を対象に実施された臨床試験においても層別解析などの手を加えずに結果をそのまま使用できることになり、よりその食品の効果を示すハードルが低くなったと言えるのです。
さらに今年は新規性のある機能性表示が続々と受理されています。コラーゲンペプチド(GPHyp)を関与成分とした「膝関節の違和感(摩擦音)を軽減する」、ロダンテノンBを関与成分とした「糖化ストレスを軽減することにより肌の潤いを保持する」など、これらは臨床試験の実施により受理されています。中でも目を引くのは、黒ショウガ由来5,7-ジメトキシフラボンおよび黒ショウガ由来5-ヒドロキシ-7-メトキシフラボンを関与成分にした「自転車運動をサポートする」という表示です。通勤手段として「自転車」を選択肢に入れることが珍しくない今日この頃、この表示を目にしたサラリーマンはきっと商品を手に取るでしょう。しかもこの表示はSR(システマティックレビュー)での評価、つまりコストのかかる臨床試験の実施ではなく、既存の文献の収集、精査にて評価されているのです。
前述の軽症者データ使用領域の緩和により、機能性表示の可能性が一段と拡がりました。「自転車運動をサポート」など、見落としがちな潜在的ニーズに対し、SRで評価を実施するには、臨床試験受託機関や研究者の専門スキルが必要であることは間違いありません。 新規性のある表示は今後もますます増えることが予想されます。
機能性表示食品 ヘルスクレームの開発(1)
2019.7.1
機能性表示食品の受理件数が増える毎に、機能性表示食品として受理されるだけでは、他社商品との差別化が難しくなり、ヘルスクレームの差別化により、他社商品との差別化を図る傾向が強まっています。
ヘルスクレームの差別化については、いくつかの手法がありますが、今回は商品のターゲットとなる顧客を想定して、顧客の具体的生活パターンからヘルスクレームを開発する手法について観ていきます。
【機能性関与成分名】:アスタキサンチン
【表示しようとする機能性】:本品にはアスタキサンチンが含まれるので、日常生活における仕事や勉強などのデスクワークと運動の両方の組み合わせによって生じる一過性の疲労感を軽減する機能があります。
通勤通学や営業に伴う「運動」を考えると、サラリーマンや学生の大半が、「仕事や勉強などのデスクワーク」と「運動」を日常的に行っていますので、一過性の疲労を感じているサラリーマンや学生を、ターゲットとしていると仮定します。
続いて、「仕事や勉強などのデスクワーク」と「運動」の臨床試験での負荷の方法については、以下の論文の通りです。
【論文より抜粋】
「日常的に起こる疲労、すなわち精神と肉体の両負荷後に生じる疲労、に与えるアスタキサンチン摂取の有効性を調べることを目的として、疲労を感じている20歳~64歳の健常男女を対象に無作為化プラセボ比較二重盲検試験を実施。
精神負荷として内田クレペリン(日本・精神技術研究所株式会社)を用いた延べ30分間の連続加算作業の後、肉体負荷として自転車エルゴメーターを用いた30分間の連続自転車走行を被験者に課した。
精神と肉体の両負荷から構成される日常生活で生じる疲労感を軽減することを確認した。」
機能性表示食品のガイドラインには、可能な機能性表示の範囲として、下記の3つが例示されていますので、本件の本質的な機能性は「一過性の疲労の軽減」となります。
(1)容易に測定可能な体調の指標の維持に適する又は改善に役立つ旨
(2)身体の生理機能、組織機能の良好な維持に適する又は改善に役立つ旨
(3)身体の状態を本人が自覚でき、一時的な体調の変化(継続的、慢性的でないもの)の改善に役立つ旨
本件においては、「一過性の疲労軽減」という機能性について、臨床試験での負荷の方法を、 精神負荷と肉体負荷の2つに分けることにより、
・精神負荷として内田クレペリン検査による加算(計算)作業
・肉体負荷として自転車エルゴメーターを用いた連続自転車走行
「日常生活における仕事や勉強などのデスクワークと運動の両方の組み合わせによって生じる一過性の疲労感を軽減する機能があります。」というヘルスクレームに結び付けています。
このように、臨床試験の方法を工夫することにより、様々なヘルスクレームの開発が可能となります。
健康機器分野での「トクホ」
2019.6.1
(一社)日本ホームヘルス機器協会が「体調改善機器制度」をスタートさせました。一般消費者には聞き慣じみのないこの「体調改善機器制度」。同協会のホームページには、制度発足の目的として「家庭向け健康機器等の安全性や機能の妥当性を審査し、一定の水準に達している機器等を体調改善機器として認定することにより、信頼と安心感によって消費者が自身のニーズに合う機器等の確保に資すること」と記載されています。また協会は、同認定事業について「トクホや機能性表示食品制度と観点は同じ」と説明しています。つまり「体調改善機器」とは健康機器版の“トクホ”という認識になります。
日本人の健康意識が高まる昨今、トクホや機能性表示食品の市場が年々拡大すると同時に、健康機器の分野でも好調が続いています。今回新たに「体調改善機器」という新しいカテゴリーが生まれたことでその動きはさらに強まることでしょう。すでに消費者からの信頼を得ている“トクホ”と「体調改善機器」を結びつけてマーケティングすることも戦略として有効です。この新たな制度が業界に与える影響は未知数であるといえます。
体調改善機器の申請には、「商品の機能や特徴を示すデータ」「商品の安全性を示す根拠資料」「製造工程を示す資料」「取扱説明書」といった資料を提出する必要があります。しかし、製品の効果効能を科学的根拠に基づいて示したエビデンスが優先的に審査されている訳ではありません。あくまでも同協会により認定され、法的根拠はなく、薬機法対象のいわゆる「医療機器」とは一線を画すかたちになっています。「体調改善機器」の広告で「医療機器」と誤認されるような効果効能を標榜すれば、行政から指摘処分を受けることになり、今後、制度活用を検討している企業にとっては不安となる要素も残っているようです。
4月に公開された第1回目の審査では、申請のあった12品目のうち6品目が「体調改善機器」に認定されました。認定された品目には、認定製品であることを示すロゴマークが貼付されます。東京オリンピックを間近に大きく動き始めるスポーツ、フィットネス業界のマーケット、そこで消費者が「体調改善機器」を目にする機会も増えることでしょう。製品に添付された「お墨付き」は消費者の目に留まり、購買意欲を掻き立たせることは間違いありません。この新しいカテゴリーに商機が訪れています。
食薬区分 運用改善の機能性表示食品への影響
2019.5.1
■「専ら医薬品リスト」運用改善通知〜厚生労働省
厚生労働省より、3月15日、食薬区分の「専ら医薬品リスト」に収載されている成分(専ら医薬成分)を元から含む生鮮食料品、その加工食品について、専ら医薬成分を含むことのみを理由に医薬品に該当するとは判断しない旨の通知が出されました。
■専ら医薬成分を機能性関与成分としてOK~消費者庁
これに合わせ、消費者庁も15日、機能性表示食品に関する質疑応答集(Q&A)の一部改正を行い、医薬品に該当しないと判断される場合に限り、専ら医薬成分を機能性関与成分とする届出を「妨げない」考えを明記しました。
■「専ら医薬品リスト」運用改善の詳細
厚労省の通知は、Q&A形式で出され、専ら医薬成分を元から含む生鮮食料品、それを活用した加工食品の医薬品該当性は、食経験や製品の表示・広告、販売の際の演術などを踏まえて「総合的に判断する」とされました。
加工食品には、タブレットなどサプリメント形状も含まれ、「伝統的発酵」で専ら医薬成分が含有されるようになる食品も含むと明記されました。伝統的とあるが、昔ながらのかめを使ったような発酵に限定しているわけではなく、発酵食品で一般的に使われるタンク発酵も該当すると考えられます。
加工食品には、製造過程で専ら医薬成分を抽出、濃縮、純化を目的とした加工をしていないこと、かつ、食品由来でない専ら医薬成分を添加していないことの、2つの条件が設けられました。
専ら医薬成分を元から含む生鮮食料品を使った加工食品の医薬該当性の判断の要点は、専ら医薬成分を主に摂取させる目的で抽出、濃縮、純化などの加工を製造工程で行っていないかどうか。そうした加工を施していれば、食品ではなく医薬品成分を摂取させる目的のものと見なされ、医薬品に該当すると判断される可能性が高いと思われます。
■機能性表示食品の可否判断基準
機能性表示食品については今後、専ら医薬成分を機能性関与成分にした届出は、医薬品該当性が明確でない場合、届出書類確認時に消費者庁が厚労省に照会、確認する手続きが取られます。
■運用改善の背景
もともとは、専ら医薬品リスト収載成分を含む生鮮食料品や、サプリメントなどの加工食品を機能性表示食品として届け出られるようにするため、業界団体の健康食品産業協議会と、医薬品や化学品、食品などを手掛ける企業が参画するバイオインダストリー協会(JBC)らが、政府の規制改革推進会議に要望していたもの。2017年秋から規制改革推進会議の医療・介護ワーキンググループで議論されていました。
■機能性表示食品の届出が見込まれる成分
JBCでは規制改革への要望にあたり、機能性表示食品の機能性関与成分として活用したい専ら医薬品リスト収載成分名を具体的に示していた。主に、γ‐オリザノール(玄米)、S‐アデノシルメチオニン(=SAMe、酒粕)、デオキシノリジマイシン(桑葉)の3成分。まずはこれら3成分から、機能性表示食品の届出が進んでいきそうです。
■その他の影響
特定保健用食品においては、「医薬品的効能効果を標ぼうしない限り医薬品と判断しない成分本質(原材料)」を関与成分とした商品が、許可されなかったケースがあります。
今回の「専ら医薬品リスト」の運用改善により、「医薬品的効能効果を標ぼうしない限り医薬品と判断しない成分本質(原材料)」を関与成分とする機能性表示食品が新たに届出される可能性もありそうです。
機能性表示の落とし穴
2019.4.1
健康産業新聞の調査で、2018年に販売された健康食品・保険機能食品の新商品のうち、3割が機能性表示食品だったことが明らかになりました。過半数を占めたのは健康食品で59%、次いで機能性表示食品の30%、栄養機能食品が6%、特定保健用食品は5%という結果が出ています。公的な統計ではないものの、全体の市場規模は8,000億円から1兆円、機能性表示食品だけでも2,000億円と推定されており、今後も拡大を続けるものと思われます。
勢力を拡げる機能性表示食品ですが、その届出表示が問題になるケースがあります。消費者庁は昨年末、「歩行能力の改善」と表示した12社15製品に対し、薬機法(医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律)に抵触する可能性があるとして、販売者に対応を求めました。事前チェックを受けた届出表示が薬機法違反と指摘される事態に事業者の間では困惑が生じています。そもそも薬機法規制から除外されているはずの機能性表示食品で、なぜ今回のような事態が起きたのでしょうか。
実は、薬機法を所管する厚労省の強い意向が裏で糸を引いているようです。消費者庁、厚労省ともに明確な回答には至っていませんが、「歩行能力の改善」効果をうたった医薬品の有無が気なります。厚労省は「医薬品に該当する可能性があるので注意が必要」と回答しており、やはり機能性食品の表示と医薬品の効果が重複したことに指摘の発端があるようです。
一方で、機能性表示食品には「改善」を表示し、受理・販売されているものは多く存在しています。今回のような事態となってしまう理由、その論点は医薬品に同様の効果をうたった物があるかないか。今後、事業者は「身体的な疲労感を軽減することで(歩行機能の改善)」「ひざ関節の柔軟性・可動性をサポートすることで(歩行機能の改善)」など前後の文脈に工夫を加えることで、厚労省の極めて微妙なさじ加減を窺う必要があるでしょう。
今回指摘された機能性表示食品はすべてSR(システマティックレビュー)を利用し届出されたものでした。SRは低コストにて機能性表示の届出が可能で、多くの中小企業が利用しています。スピードを求める企業にとって短期間で実施できるSRですが、スピードを求めることで、今回のような予想だにしない落とし穴にはまる可能性もあります。回避するには、臨床試験受託業社等の専門家と機能性表示についてもしっかり議論を重ね、最終製品による臨床試験を実施することも、急がば回れの勝負事として視野に入れると良いでしょう。
景品表示法 打消し表現
2019.3.12
■健康食品の表示及び広告の規制
健康食品の表示及び広告に関連する法律は景品表示法、健康増進法、食品表示法、医薬品・医療機器等法(薬機法)の4つ。食品表示法と薬機法は、特定の表示内容を義務付ける、あるいは禁止する事前規制型の法律に分類されます。
景品表示法と健康増進法は、既に世間に出た広告を対象とする事後規制型の法律です。著しく人を誤認させるような虚偽誇大表示あるいは優良誤認表示を規制します。
ここでの「著しく」とは、その表示、表現の誇張が一般に社会に許容される範囲を超えており、一般消費者に影響を与える場合を指し、その程度が著しいかどうかは、過失・故意を問わず、社会通念をもって判断されます。
■景品表示法の打消し表示
平成30年6月に消費者庁より発表された「打消しガイドライン」に従って、平成31年1月17日 、株式会社はぴねすくらぶに対し、同社が供給する「酵母と酵素deさらスルー」に係る表示について、消費者庁及び公正取引委員会の調査の結果を踏まえ、景品表示法に違反する行為(同法第5条第1号(優良誤認)に該当)が認められたことから、同法第7条第1項の規定に基づき、消費者庁が措置命令を行いました。
【表示内容】
「酵素 酵母 乳酸菌の発酵パワーでダイエット ・・・・・!」、「食べることが大好きなあなたへ!」、「酵母と酵素deさらスルー」は、生きた酵素と酵母、乳酸菌、さらに白キクラゲ由来のエイドライフリーWJをたっぷり配合した新しいダイエットサプリ等
本件2商品を摂取の摂取により、運動や食事の制限なしに、本件2商品に含まれる成分の作用により、痩身効果が得られるかのように表示をしていた。
【表示の根拠】
当庁は、それぞれ、景品表示法第7条第2項の規定に基づき、はぴねすくらぶに対し、期間を定めて、当該表示の裏付けとなる合理的な根拠を示す資料の提出を求めたところ、同社から資料が提出された。しかし、当該資料はいずれも、当該表示の裏付けとなる合理的な根拠を示すものであるとは認められないものであった。
【打消し表示】
前記の表示内容について、自社ウェブサイトにおいて、「※使用感・結果には個人差があります。」と記載していたが、当該記載は、一般消費者が当該表示から受ける効果に関する認識を打ち消すものではない。(消費者庁 資料より 引用)
【ポイント】
一部の都合の良い体験談のみを引用する場合不当表示となる。
「個人の感想です」
「効果には個人差があります」
等の打消し表示は、一部の都合の良い体験談のみの引用に当たる。
【新たなガイドライン】
1.被験者数、属性
2.体験談と同様の作用や実感 が得られた割合
3.体験談と同様の作用や実感 が得られなかった割合
の明記が必要
■打消し表示に必要なエビデンス
景品表示法に対応する食品臨床試験としては、これまで機能性に関する有効性試験が行われていましたが、今後はVASアンケート試験等を組入れる必要があると考えます。
「体験談と同様の作用と実感」の「作用」については、食品臨床試験から得られるデータ等の客観的指標にて説明されるものであるのに対し、「実感」については、アンケート等による被験者の主観的指標にて説明されるものです。
VASアンケート試験は、論文投稿も可能なアンケートとして、学術的にオーソライズされているので、より確かなエビデンスになると思われます。
「肌トクホ」から観える特定保健用食品と機能性表示食品の違い
2019.2.4
■日本初の肌トクホ
ポーラ・オルビスグループのオルビスが1月1日、日本で初となる肌トクホ「オルビス ディフェンセラ」を発売しました。トクホ(特定保健用食品)とは、体の生理学的機能などに影響を与える関与成分を含み、健康増進法第26条第1項の許可を受け、その摂取により、特定の保健の目的が期待できる旨が表示(保健の用途の表示)されている食品です。つまり、肌トクホとは肌への機能がある特定保健用食品ということになります。
ディフェンセラのパッケージには「肌の水分を逃しにくくします」と記載されており、希少性の高いグルコシルセラミドが、「インナーアクアバリア」を形成し、肌の水分を逃しにくくするというメカニズムです。
同開発チームは申請までに6年、審査に4年、計10年の歳月をこの肌トクホの開発に費やしており、同社小林琢磨社長は、「特定保健用食品は国の認可が必要なもの。各企業の判断で行う機能性表示食品とは、根本的に違う。肌への効果を唄えるディフェンセラは、従来の化粧品と食品の境目をなくす、スキンケアの新たな形となる商品である。」と話しており、今後、同社の主力商品になる事でしょう。
■特定保健用食品より先行する機能性表示食品
日本初の肌トクホの販売は画期的ですが、実は肌の水分保持、乾燥緩和に関する食品は、トクホよりも先に機能性表示食品で販売されています。その届出数はすでに130品を超えており、エーザイの「チョコラ BB®リッチセラミド」や、資生堂の「飲む肌ケア」などが挙げられます。資生堂は2016年、オルビスよりも先に「素肌ウォーター」で肌トクホの許可を得ていましたが、販売までには至らず機能性表示食品の「飲む肌ケア」を販売しています。「特定保健用食品」と「機能性表示食品」。その違いは何なのでしょう。
■特定保健用食品と機能性表示食品の違い
特定保健用食品が、国(消費者庁)の事前審査を経て許可が下りるのに対し、機能性表示食品は、国の審査や許可は不要で、事業者の責任においてエビデンスを届け出る仕組みです。そのため特定保健用食品は莫大な投資や歳月、手間が必要であり、結果として大企業の商品ばかりが並んでいます。それに対し、機能性表示食品の届出は、研究レビューで既存のエビデンスを掘り起こすことにより、事業者自身が新たな研究をする必要がなく、費用面や時間のハードルが低くなっているのです。
2015年にスタートした機能性表示食品の受理数は、今年1月時点で1509品、一方のトクホは27年の歴史があるなか、許可数1063品。この数字からもトクホのハードルの高さが窺えます。どちらも販売にまで至れば、事業者に大きな利益をもたしますが、中小企業やベンチャー企業は機能性表示食品制度の活用こそが勝機と捉えることができるでしょう。
認知機能評価の試験設計
2019.1.7
認知機能評価に関する臨床試験において、有意な結果を得るための試験設計について考えてみます。
■認知機能評価試験の事例
松山大学、愛媛大学、えひめ飲料の産学官連携により、「河内晩柑」に含まれる成分での認知機能維持・改善に対する研究結果から、えひめ飲料が機能性表示食品として国内初となる「オーラプテン」での機能性関与成分の届出となった、臨床試験を例に検討致します。(2018年7月27日届出「POMアシタノカラダ 河内晩柑ジュース」)
【方法】
認知能力や記憶力を示す指標として、認知機能全体の評価はMMSE検査、記憶力の維持及び高める機能の評価は10単語想起テストの3回繰り返しによる検査を実施した。
健康な中高年者84名を対象にプラセボ対照二重盲検無作為化試験を実施した。無作為にオーラプテンが6mg/日含まれる125mlの試験ジュースとオーラプテンが0.1mg/日含まれる同じ容量のプラセボジュースを24週間継続して飲用した。試験開始直後と24週間後にMMSE検査、10単語想起テスト、血液生化学的検査を行い、統計解析にて比較評価を実施した。
【主な結果】
2名が途中で試験参加を中止したため、82名(試験ジュース群41名、プラセボ群41名、年齢(平均±標準偏差:71±9歳)、女性55名、男性27名)を最終分析対象者とした。MMSEで認知症と診断された参加者はいなかったが、試験終了時に3名の参加者が軽度認知障害と診断された。
10単語想起テストスコアの変化率において、試験ジュース群においてプラセボ群との比較により有意に高い(P<0.05)結果であった。このことから、オーラプテンを含む飲料を摂取することは、「健康な中高年者の認知機能の一部である記憶力(言葉を記憶し、思い出す力)を維持する機能」が認められた。
また、本試験ジュースの摂取により血液生化学的検査のパラメーターのいずれも試験中に有意な変化が認められず、試験ジュースが原因と思われる有害事象の発生も認められなかったことからヒトにおける試験ジュースの安全性も確認された。
■認知機能評価試験の重要ポイント
認知機能評価試験においては、事例のようにMMSE検査や単語想起テストを実施するケースが一般的ですが、その場合、被験者の意識状態にバラツキがあると精度の高い結果が得られないケースが見受けられます。起床して間もなくで集中力を欠いている方もいれば、何等かの気がかりなことがあり意識が散漫になっている方もおられます。
では、被験者の意識状態を一定にするにはどのようにすればよいのでしょうか?様々な方法が考えられますが、弊社の過去の臨床試験結果から検討すると、単語想起テスト等を実施する前に何等かの負荷をかけることで集中力が増し、被験者本来の集中力が発揮された状態、即ち一定の意識状態が保たれるのではないかと考えています。
負荷については、いろいろな方法が考えられますが、重要なのは集中力を要する何等の負荷である必要があると考えられます。今後も臨床試験の実施結果から、最適な方法を検討して参ります。
厳しい景品表示法(2)
2018.12.13
景品表示法違反行為による健康食品販売企業への課徴金納付命令が、相次いでいるようです。
景表法に違反する行為、すなわち、機能性表示食品において不当な表示や、過大な景品類の提供が行われている疑いのある場合、消費者庁から「裏付けとなる資料」の提出が求められ、さらに事業者への事情聴取が行われます。調査の結果、「合理的な根拠がない」と判断された場合は、その事業者に対し、不当な表示で消費者に与えた誤解の排除、再発防止策などの「措置命令」が下されるのです。追っては、事業者が不当表示をする行為をした場合、景品表示法第5条第3号に係るものを除き、その他の要件を満たす限り、当該事業者に対し、売上の3%の課徴金納付も命じられます。
以前のコラムでも触れていますが、「太れない体質だとあきらめたくない!」「女性らしい美ボディに!健康的にふっくらしたい」と表示した販売企業が景表法違反で摘発されています。該当する健康食品の売上高は8,878万8,836円で、その3%に当たる266万円の課徴金支払いが期限付きで命じられました。
また、別の企業では、「視界爽快」「小さな文字や画面もバッチリ!」という表示が、景表法違反と判断され、1814万円の支払い命令、さらに別企業の「痩せやすい習慣を作る!」「149種類の酵素で燃えるカラダを作る!」には歴代2位となる1億886万円もの課徴金支払い命令が下されているのです。課徴金が1億を超えるということは、売上にすると36億3000万ほど。それだけ人気がありヒットしていた商品だけに、法違反で摘発され、ホームページに謝罪文を掲示するといったイメージダウンは、企業にとって大きなマイナスです。同社は商品のPRに有名タレントを起用していたこともあり、商品販売への出資も大きかったに違いないでしょう。
消費者庁は消費生活センターに集まる消費者からの苦情を元にして、違法調査に乗り出しているようです。苦情から読み取れる機能性の効果は、消費者個人の主観も入るため一様とはなりませんが、苦情が多く寄せられ調査対象になった場合、その「根拠となるエビデンス」を示せるかどうかがカギとなります。機能性表示食品の届出条件である、「システマティック・レビューによる既存エビデンス」や「最終製品で実施したヒト試験」の解釈には、専門的な考究が必ず必要であり、素人目で機能性の根拠となるか否かを判断することは極めて危険なことです。事が起こった後で詳しく確認してみると、全く合理性のない結果を示していた、なんてもことにもなり兼ねません。
精力を注ぎ完成させた自社商品だからこそ、適切に専門家を利用し、厳たる健食制度へ勝負を挑みたいですね。
機能性表示食品の動向
2018.11.06
今年3月に機能性表示食品制度のガイドラインが大幅に改正され、4月以降の届出受理数は大きく停滞しました。しかし9月には、そのペースは回復し累計で1,400件を超え、さらなる加速も予想されています。4月から8月にかけての公表は55品、これに対し9月は単月で63品が公表されました。今年度、目立つ成分には、GABA、HMB、アフリカマンゴノキ由来エラグ酸、ターミナリアベリリカ由来没食子酸など。GABAは相変わらず好調で、HMBも躍進を遂げています。
一方、通算受理数が190品を超え、依然としてトップを維持する難消化性デキストリンですが、今年度の受理数は7品と低迷しています。制度4年目にして、届出トレンドに変化が起きたのでしょうか。
機能性表示食品の半分以上を占めている加工食品(サプリメント形状のものは含まない)ですが、そのうちの2割を占める成分が難消化性デキストリンです。水に溶けやすいため水溶性食物繊維として、体内で多様な生理機能を示すことが、過去の研究で報告されています。受理されている作用で最も多いのは中性脂肪低下と血糖値抑制、次いで整腸作用と続きます。
さらにサプリメントとそれ以外の加工食品では、摂取する際の容易さに違いがあります。当然、買われ方にも違いが生まれ、飲料に含有しやすい難消化性デキストリンは、気軽に手に取れるダイエット食品として魅力を放つこととなります。ではなぜ、難消化性デキストリンは今年度の受理数を落としているのでしょうか。
機能性表示食品制度では、コストのかかるヒト臨床試験をわざわざ実施しなくても、表示しようとする機能性を客観的に示すことのできる研究レビュー(システマティックレビュー)によって、その届出は受理されます。しかしこの研究レビューによる既存のエビデンスは、「大方使い果たされた」という見方も存在しているようです。また研究レビューによるヘルスクレームは他社との差別化が難しいため、魅力的に映らないのかもしれません。もしそうであれば、最終製品でのヒト臨床試験を選択し、オリジナルのヘルスクレームを目指すほうが賢明かもしれません。時間とお金に余裕のある大企業ではないかぎり、スマートな受理へのプロセスを考えることも非常に重要です。高額なコストに見合った大きなリターンは、その初めの一歩より起こりえます。
厳しい景品表示法
2018.10.01
機能性表示に対応した食品が次々と販売開始される中、違法なサプリメントの摘発が相次いでいます。
7月25日、消費者庁は、「太りたい人向け」にサプリメントを販売した企業に対し、「根拠が認められない」として景品表示法に基づく措置命令を下しました。
同社は、サプリメン
トの同梱チラシまたはホーページにて、 「太れない体質だとあきらめたくない!」、「女性らしい美ボディに!健康的にふっくらしたい」など、あたかも簡単に肥満効果が得られるかのような表示・宣伝を行っていたようです。これに対し消費者庁は、「裏付けとなる資料」の提出を求め、同社から提出された資料には「合理的な根拠がない」と判断しました。
さらに7月30日にも「豊胸効果」を謳ったサプリ販売企業に対し、景品表示法違反として、再発防止策等を求める措置命令が出されています。同社の表示・標榜は、「うつむくと胸が邪魔して下が見えない」、「94%が2カップ以上UPを実感」というもので、著しい豊胸効果が容易に得られるかのような表現となっていました。」
そのほかにも、ダイエット健康食品の、「米袋2個分の脂肪がお腹から除去」 に対して、再発防止措置命令、がん予防健康食品の、「ガンにならないためにはこれを飲んでいたらいいんです」といった標榜には、業務禁止命令が下されています。
もちろん、過度に期待を煽る表示はご法度です。しかしこれらのケースに限らず、どの機能性表示食品でも、消費者の購買欲をくすぐる、巧みな言葉の‘‘心理戦“を展開している事は共通です。そして制度では、「安全性・機能性に関する科学的根拠の内容およびその説明責任」を販売企業に課しています。つまり、巧みな言葉表示の根拠となる資料を求められた際、速やかにそれを提出し、かつ合理的な根拠として判断されなければいけないという事になります。その責任を果たせなかった場合のみ、上述のような厳しい処遇を受けてしまうことになるのです。
一方で、巧妙な言葉の‘‘心理戦“をものにし、順調に売り上げを伸ばす食品も存在しています。その明暗の分かれ目はどこなのでしょうか。
中小企業にとって、研究開発への投資は可能な限り抑えたいところでしょう。しかし、その経営戦略が仇となり、消費者庁からの摘発を受けてしまうことになれば、経済的ダメージは甚大です。やはり「専門家によるシステマティック・レビュー」および「専門業者によるヒト臨床試験でのエビデンス」を元に機能性表示食品として届出をすることこそが、その後のリスクを小さくすると言えるかもしれません。
明暗のカギを握っているのは機能性表示食品
2018.09.03
健康産業新聞編集部の調査によると、全国200社の健康食品受託製造・加工企業のうち、前年の売上を上回った企業は全体の58%、下回った企業は27%という結果が示されています。さらに上回った企業は前年と比較し7ポイント減少、下回った企業は、前年と比較し8ポイント増えており、この結果から企業間の格差が、より鮮明になっていることが窺えます。
明暗のカギを握っているのは、やはり機能性表示食品だといえるでしょう。2015年に制度がスタートし、健康食品市場の勢力図に大きな影響を与えました。調査ではさらに、機能性表示食品制度に対する評価についても聞いています。「評価している」と回答した企業は全体の23%、「どちらともいえない」と回答したのは全体の47%でした。つまり、約半数の企業は制度に否定的であり、その理由には「対応が遅い」「指摘が時に応じて変わる」「大手優先の制度」といった意見が上がっています。特保と比べて、時間的にもコスト的にもハードルの下がった機能性表示食品ですが、中小企業にとっては取得を困難と感じるところが多いようです。しかし、この一大ビジネスチャンスをこのまま逃してしまってよいのでしょうか。
第3次ガイドライン改正により「対応が遅い」「指摘が時に応じて変わる」といった理由は解消されると予想できますが、研究に不慣れな方には難しい研究レビューや専門知識を必要とする臨床試験は、大学や試験受託機関を活用せねばなりません。そこには一定のコストがかかるため、中小企業であれば研究への投資を躊躇しがちですが、そこに巨大なメリットが隠れていることを忘れてはいけません。
臨床試験の実施は独自のエビデンスを構築し、他社製品と差別化されたオンリーワン商品を生むことになります。さらにエビデンスを得た機能に特許を取得すれば、その価値はより強固なものになるでしょう。
そして、戦略的なマーケティングも必須といえるでしょう。売れている商品はパッケージで見事な"言葉遊び"を展開しています。もちろん、科学的根拠に基づく範囲内であることは前提ですが、消費者が健康イメージを駆り立てるような、明確な言葉選びが重要になります。
そのためには、臨床試験を実施する際に、最終的に目指す結果・ヘルスクレームをイメージして計画することが必要です。試験デザイン・被験者・測定項目などを検討するとき、なぜ【何を目的に】この臨床試験を行いたいのかを明確にしたうえで食品CROへ相談することがよいでしょう。
食品表示に関する消費者意向調査報告書について
2018.08.03
消費者庁が5月31日に公表した、2017年度「食品表示に関する消費者意向調査報告書」において、機能性表示食品の現在摂取率が9.9%であったことが明らかになりました。
この報告書は、今年1~2月にかけて、全国の15歳以上の一般消費者を対象に、食品表示制度の理解・活用状況、課題、要望などの調査結果になります。
「保健機能食品」の現在の摂取率に関する問いに対し、「現在摂取している」と回答したのは、栄養機能食品で9.8%、特保では15.2%となり、前年度調査での、10.2%、18.0%から低下を示しました。一方、機能性表示食品では、16年度、17年度ともに、9.9%となり、摂取率を維持した形となっています。
また、「以前摂取していたが、今は摂取していない」と回答したのは、栄養機能食品で16.9%、特保で25.5%、機能性表示食品では15.0%となり、特保の現在摂取率の低下と合わせ、消費者の特保離れが懸念されます。
さらに、「摂取したことはないが、今後摂取してみたい」と回答したのは、栄養機能食品で35.2%、特保で27.5%、機能性表示食品では36.8%となり、消費者の機能性表示食品に対する期待度が高まっていることが窺えます。飛ぶ鳥落とす勢いの機能性表示食品が、特保を射程圏内に捉えつつあると言っても過言ではないでしょう。
この調査では、食品表示制度への理解度、保健機能食品の認知度も調査されています。食品表示制度への理解度に関する設問では、一番歴史の長い特保が32.3%と最も高く、次いで栄養機能食品で15.3%、機能性表示食品で8.1%と続きます。いずれも消費者の理解度は低く示されましたが、施行されてからの期間に比例しており、妥当な結果とも言えます。
また、保健機能食品の認知度においては、栄養機能食品15.3%、特保29.6%、機能性表示食品15.8%と、テレビCMや広告の影響を大きく受ける特保の認知度が、依然として高く示されました。しかし、施行後わずか3年の機能性表示食品が、17年の歴史を持つ栄養機能食品を上回る認知度を示したことは、興味深い結果となっています。
今回の調査報告書で、食品表示制度への理解度、保健機能食品への認知度の低さが浮き彫りになりました。今後、国はどのような対策をとるのでしょうか。
食生活の偏りから罹る生活習慣病や歯止めの効かない少子高齢化により、医療費は増大を続けています。救世主として投入した機能性表示食品に期待するのは、国も消費者も同じです。
今後、各企業のマーケティング戦略も大きなカギとなります。研究への投資も含め、消費者によりわかりやすい表示を示すことができれば、さらなる販売増進、常飲者の拡大へと繋がることになるでしょう。
機能性表示食品制度のガイドライン改正
2018.07.06
高齢化社会へと突き進んでいるわが国では今、空前の健康ブームが起きています。健康ブームを支えているのが、1991年に開始された特定保健用食品、2001年から始められた栄養機能性食品を含めた保健機能食品制度、そして2015年4月に新たな制度として施行された機能性表示食品制度である。機能性表示食品制度は今年で4年目を迎え、その届出数は6月11日現在で1382件となりました。制度を利用し販売に至った食品はその売り上げを好調に伸ばしているようです。
3月28日、消費者庁は3回目となる「機能性表示食品の届出等に関するガイドライン」の改正を公表しました。
同日に行われた記者会見において、赤﨑暢彦(消費者庁食品表示企画課長)氏は、「かなり大幅な修正」と説明しており、消費者へのメリットはもちろん、機能性表示食品メーカーにとって、これまで以上の大きなビジネスチャンスが存在していることは間違いないでしょう。
今回の改正によって、「対象となる機能性関与成分の拡大」が行われ、新たに「糖質・糖類」が対象に追加されました。ガイドラインには「栄養源(エネルギー源)とされる成分(ぶどう糖、果糖、ガラクトース、しょ糖、乳糖、麦芽糖及びでんぷん等)を除いた糖質、糖類が対象成分になる」としたうえで、例として、糖質には、キシリトール、エリスリトール、フラクトオリゴ糖、キシロオリゴ糖、ガラクトオリゴ糖、乳果オリゴ糖(ラクトスクロース)、糖類には L-アラビノース、パラチノース、ラクチュロースが挙がっています。
4月24日時点での糖質・糖類の届出事例はありませんが、今後の主体となるのはおそらくオリゴ糖だと言えるでしょう。すでに特定保健用食品では整腸作用で6種類が認められており、ヒト試験でのエビデンスも存在します。これらについては、システマティック・レビューによる整腸作用での実施が最も早い届出受理と考えられます。
一方で、オリゴ糖の機能性として期待の高い、血糖値、血清脂質や中性脂肪の上昇抑制作用などは、届出に必要とされるヒト試験レベルでのエビデンスが十分ではなく、今後、その需要は増すことが予想されます。各種試験実施に必要な専門知識・設備をそなえた食品試験受託企業は、その存在感を強めていくことになるでしょう。